کروموزوم پلیتن، کروموزوم غول پیکری است که در غدد بزاقی مگس سرکه وجود دارد و به دانشمندان کمک میکند تا تغییرات ژنتیکی را بررسی کنند و از تقسیمات سلولی ایجاد میشود که طی آن DNA همانندسازی میکند ولی تقسیم هسته و سلول صورت نمیگیرد. با قرار گرفتن DNAها در کنار هم اجتماع غول پیکری از ۱۰۰۰ مولکول DNA حاصل میشود که با میکروسکوپ نوری قابل مشاهده است.
مگس سرکه یا دروزوفیلا ملانوگاستر، حشره ای با دگردیسی کامل است که دارای چهار مرحله ی اصلی در چرخه زندگی خود می باشد: جنین، لارو، شفیره و بالغ. در مرحله ی لاروی، ارگانیسم با انرژی بالایی به ذخیره مواد غذایی برای رشد سریع در اندازه و ویژگی های بدنی خود می پردازد. در این مدت، غدد بزاقی باید به اندازه ی کافی بزرگ بوده و تکامل و تکوین کامل یافته باشند تا بتوانند ذخایر کافی از آنزیم های بزاقی مسئوول هضم مواد غذایی را دارا گردند. غدد بزاقی دروزوفیلا و برخی دیگر از حشرات، به جای افزایش تعداد سلول های خود برای رشد قادرند حجم و توده ی سلولی خود را افزایش دهند.
غدد بزاقی دارای ویژگی های زیر می باشند
· بصورت جفت در لارو مگس قرار دارند و از نظر اندازه و شکل به یکدیگر شباهت دارند.
· زیر میکروسکوپ استرئو، ظاهری نیمه شفاف و تا حدودی براق دارند.
· هر یک از این دو غده دارای یک توده چربی کدر در اطراف خود می باشند.
بعد از اینکه در اوایل دوره ی لاروی، تعداد اولیه سلول ها ی غدد بزاقی تشکیل شد، آنگاه تقسیم سلولی متوقف می گردد. همزمان با افزایش اندازه ی سلول ها، هسته های سلولی نیز رشد می کنند. در این زمان، کروموزوم ها بطور مکرر بدون تقسیم سلولی همانندسازی انجام می دهند. و تعداد زیادی کروماتید های خواهری تولید می کنند که به یکدیگر به صورت سیناپس شده باقی می مانند. علاوه بر افزایش حجم هسته سلول ها و در نتیجه افزایش حجم توده سلولی، این سلول ها دارای توانایی متابولیکی بسیار بالایی هستند. زیرا نسخه های زیاد از هر ژن، سطح بیان ژنی را افزایش می دهد. اگرچه علت دقیق این مکانیسم غیر معمول، مشخص نیست اما به نظر می رسد که این فرایند همانندسازی مکرر، یکی از موثرترین راه ها در تولید آنزیم های بزاقی موردنیاز برای رشد و تکوین لاروها به حساب می آید.
از آنجایی که خود سلول های بزاقی تقسیم نمی شوند، هسته های آنها فرآیند میتوزی را انجام نمی دهند. به همین دلیل، کروموزوم ها در یک مرحله از اینترفاز طولانی مدت از چرخه ی سلولی باقی می مانند و تا حد ممکن بصورت کشیده شده قرار می گیرند. از آنجایی که هریک از این کروموزوم ها از تعداد بسیار زیادی زنجیره پلی نوکلئوتیدی تشکیل شده اند به آنها “کروموزوم های پلی تن” گفته می شود. پلی تن به معنای ” تعداد فراوانی رشته” می باشد. کروموزوم های پلی تن به علت اینکه کشیده شده اند و از میزان بسیار زیادی رشته ی DNA تشکیل می شوند، به آسانی زیر میکروسکوپ نوری قابل مشاهده اند.
این کروموزوم ها اولین بار در سال ۱۸۸۱ توسط Balbiani در غدد بزاقی حشره کوچک Chironomus مشاهده شد، اما ماهیت وراثتی این ساختار ها مورد بحث بود تا زمانیکه در سال ۱۹۳۰ دو فرد به نام های Emil Heitz و Hans Bauer این کروموزوم ها را در دروزوفیلا ملانوگاستر مورد مشاهده قرار دادند. در واقع، این کروموزوم ها در بافت های ترشحی سایر حشرات دو بال مثل لوله های مالپیگی در Sciara و همچنین در پروتیستا، گیاهان، پستانداران و یا در سلول های بعضی حشرات دیده می شود.
یکی از ویژگی های مهم این کروموزوم ها این است که در زیر میکروسکوپ دارای نوارهای تیره و روشن فراوانی هستند که شباهت زیادی به بارکد کالاها دارد. این نوارها برای هر کروموزوم ، منحصر به فرد است. نوار های تیره (Band) نشانگر مناطقی از کروموزوم اند که DNA درآنجا تراکم بالایی پیدا کرده و نوار های روشن ((Interband نشانگر مناطقی از کروموزوم اند که تراکم رشته های DNA در آنجا کمتر است. این نوارها، مناطق اختصاصی قابل رویتی را ایجاد می کنند که برای شناسایی مکان یک ژن خاص روی کروموزوم، جایگاه نوآرایی های کروموزومی و یا محل حذف های رخ داده روی توالی های ژنی بسیار مناسب اند. نوارهای تیره و روشن هر دو دارای ژن هایی هستند و هنگامی که یک ژن فعالانه رونویسی می شود، مناطقی بنام «پاف» (Puff) در ناحیه ی لوکوس ژن در حال رونویسی روی کروموزوم ایجاد می شود. پاف ها نشانگر مناطقی از کروموزوم اند که در آن رشته های DNA ، شکل مارپیچی (coiling) –تراکم زیاد- خود را از دست داده و در نتیجه برای انجام عمل رونویسی مناسب شده و توالی ها قابل دسترس گشته اند. پاف ها در نتیجه ی تغییرات ساختاری در کروموزوم های پلی تن ایجاد می شوند. یک کروموزوم پلی تن در مراحل پایانی لاروی دارای تعداد پاف های زیادی در باند های مختلف است. تا ۴۰ سال عقیده بر این بود که این پاف ها ناشی از فعالیت های ژنی است و چندی بعد آنها را توالی های فعال موقتی در ژن معرفی کردند. الگوهای موقتی تشکیل پاف در غدد بزاقی لارو با تزریق هورمونی بنام «اکدیزون» (ecdysone) که نوعی هورمون محرک برای پوست اندازی لارو است، قابل القاست. این عمل تحت کنترل رسپتور اکدیزون صورت می گیرد. تعداد کمی از ژن ها مدت اندکی بعد از رویارویی با اکدیزون تشکیل پاف می دهند و تعداد بیشتری از ژن ها (بیش از ۱۰۰ ژن) بعد از چند ساعت در برابر اکدیزون واکنش نشان می دهند. فرض بر این است که طول مدت تشکیل پاف، نشانگر سلسله فرآیند های ژنتیکی برای فعال سازی ژن هاست. پاف های جدید مستقل از سنتز پروتئین هاست اما پاف های قدیمی تر به سنتز قبلی پروتئین ها احتیاج دارند.
در سال های اخیر، در محل باندها، عوامل رونویسی و پروتئین های کروموزومی شناسایی شده اند. محققان معتقدند که اتصال این پروتئین ها دارای اهمیت کاربردی برای کروموزوم است و نقش این پروتئین ها را در تنظیم بیان ژنی نشان می دهد. نمونه ای از اتصال پروتئین های ویژه به کروموزوم پلی تن، پروتئین CHD1 یا (Chromo-ATPase/helicase-DNA-binding domain) می باشد. پروتئین هایی که با CHD1 از طریق ناحیه ی هلیکاز در ارتباط اند، بصورت کمپلکس های مولتی پروتئینی وجود دارند. برای مثال، محققان معتقدند که پروتئین های SNF2/SWI2/Brm در تغییر شکل دادن وابسته به ATP کروماتین نقش دارند. آنتی بادی های CHD1 ، این پروتئین را در ناحیه کم تراکم کروماتین (Interband) و همچنین پاف های موجود در روی کروموزوم پلی تن غدد بزاقی متمرکز می کند. این مشاهدات نشان می دهد که CHD1 با عملکرد خود ساختار کروماتین را طوری تغییر می دهد که بیان ژنی را تسهیل نماید.
اما الگوهای دقیق پاف ها در دو مورد با هم تفاوت دارند:
· در انواع مختلف سلول ها که دارای کروموزوم پلی تن اند. (مثل غدد بزاقی و روده)
· با تغییر شرایط یک نوع سلول شکل پاف ها دچار تغیییر می شود. برای مثال، با تزریق هورمون اکدیوزون به یک حشره تغییرات قابل پیش بینی در پاف ها رخ می دهد.
هنگامی که با هورمون اکدیوزون، آنتی بیوتیک اکتینومایسین D نیز به پاف ها اضافه شود، مراحل تشکیل پاف متوقف شده و سنتز RNA کاهش می یابد. اکتینومایسین D دسترسی RNAپلی مراز را به DNA بلوکه می کند. ( Claus Pelling, Max-Planck انستیتو بیولوژی، Tubingen). الگوی تشکیل پاف در یک در طول زمان تغییر می کند. مثلا هر بار که لارو حشرات آماده پوست اندازی می شود، یک توالی خاص قابل پیش بینی برای تشکیل پاف ایجاد می شود.
همچنین افزایش دما نیز باعث تشدید تشکیل پاف های کروموزومی می شوند.
در سال ۱۹۳۵، کالوین بریجز الگوهای نواری کروموزوم های پلی تن در دروزوفیلا ملانوگاستر مشاهده کرده و از آنها تصاویر بسیار دقیقی تهیه کرد که نقشه های حاصل از بررسی های وی هنوز نیز از لحاظ علمی معتبر و قابل استفاده است. مطالعه و تحلیل الگوهای نواری کروموزوم پلی تن، اطلاعات فراوانی را در رابطه با ساختار عمومی کروماتین و بخش های فعال رونویسی در اختیار می گذارد.
در نقشه ژنتیکی استاندارد کروموزوم پلی تن که توسط Bridges به عنوان یک رفرنس ارائه شد، بازو های این کروموزوم به ۱۰۲ بخش (division) شماره گذاری شده تقسیم می شود. هر یک از پنج بازوی اصلی ( X, 2L, 2R, 3L, 3R) دارای ۲۰ بخش اند. فقط کروموزوم شماره IV دارای دو بخش است. کروموزوم شماره I یا کروموزوم X از ۲۰-۱ بخش، کروموزوم II از ۶۰-۲۱ بخش، کروموزوم III از ۱۰۰-۶۱ بخش و کروموزوم IV (کوچک ترین کروموزوم ها) از ۱۰۲-۱۰۱ بخش تشکیل شده است. هر یک از این بخش ها با یک نوار اصلی آغاز شده و به ۶ زیر بخش (subdivision) که با حروف A تا F نشان داده می شوند تقسیم می شوند و این ۶ زیربخش خود به بیش از ۱۳ زیر مجموعه خطی تیز تقسیم می شود. بنابراین، هر یک از نوارهای کرموزوم پلی تن با شماره ی بخش، زیربخش و شماره ی نوار آغازگر هر زیربخش شناسایی می شوند. Bridges حداقل تعداد نوارها را برای کروموزوم های غدد بزاقی مگس سرکه بصورت زیر اعلام کرد: ۵۳۷ نوار برای کروموزوم X ، ۱۰۳۲ نوار برای کروموزوم II، ۱۰۴۷ نوار برای کروموزوم III و ۳۴ نوار برای کروموزوم IV که در مجموع حداقل ۲۶۵۰ نوار برای کل ژنوم گزارش نمود. اما تحقیقات اخیر نشان می دهد که تعداد این نوارها ۳۲۸۶ عدد می باشد. افزایش این رقم احتمالا به علت خطاهایی بوده که در آزمایشات قبلی وجود داشته است. (Sorsa, 1988) معمولا جایگاه بسیاری از ژن ها با تعیین میزان رزلوشن یا میزان تفکیک یک زیربخش و معمولا به همراه تخمین جایگاه عددی آنها شناسایی می شوند. (مثل ۴۲C7-9, 60A1-2). اگرچه تقسیمات کروموزوم پلی تن در کل رشته ی DNA وجود ندارد اما به طور میانگین، یک زیربخش حدود ۳۰۰ جفت باز از DNA و بین ۱۵ تا ۲۵ ژن را در بر می گیرد.
در این بررسی آزمایشگاهی بطور کلی ۳ هدف عمده دنبال می شود:
· جدانمودن غدد بزاقی از لارو سن III دروزوفیلا
· فراهم کردن اسمیر های (squash) مناسب از کروموزوم های پلی تن دارای نوار
· مشاهده کروموزوم پلی تن و پاف های موجود روی آن
مواد و روش ها:
برای مشاهده ی کروموزوم پلی تن، ابتدا یک لام میکروسکوپ آماده کرده و روی آن یک قطره اسید استیک۴۵% می ریزیم. یک لارو سن III برداشته و آن را به درون اسید روی لام منتقل می کنیم. سپس لام را زیر میکروسکوپ استرئو قرار می دهیم. بعد از تنظیم و وضوح تصویر، لارو در حال جنبش را تشریح می کنیم. با استفاده از دو سوزن تشریح، حرکت لارو را کنترل کرده ، یک سوزن را پشت لکه تیره دهانی لار به آرامی فرو می کنیم و سوزن دیگر را در نزدیکی ناحیه شکمی ثابت می کنیم. آنگاه به آرامی و با دقت دو سوزن را در جهت های مخالف هم حرکت می دهیم به طوری که سطح بدن در ناحیه کشش پاره شده و محتویات درون لارو در این ناحیه قابل مشاهده گردد. اگر با دقت محتویات بیرون ریخته را مورد مشاهده قرار دهیم دو غده ی بیضی شکل متقارن را خواهیم دید که به مواد کدر رنگی متصل اند. این دو غده همان غدد بزاقی و مواد کدر رنگ نیز چربی های همراه با آن اند. به کمک سوزن ها ی تشریح، غدد بزاقی را از مواد فرعی مانند اجسام چربی و لوله های گوارشی آن جدا نموده و آنها را به روی یک لام جدید منتقل می کنیم. در اینجا باید نهایت دقت لازم را بکار برد تا غدد بزاقی حین انتقال آسیب نبینند. سپس با تکه ای کاغذ صافی اسید اضافی را که احتمالا با غده ها منتقل شده حذف می کنیم.-کاغذ را با حفظ فاصله ی مناسب از نمونه روی قسمت آغشته به اسید لام می گذاریم تا اسید اضافی را به خود جذب کند. سپس چند قطره رنگ استواورسئین به غده ها ی بزاقی اضافه می کنیم و لام را در مکانی مناسب به مدت ۲۰-۱۵ دقیقه قرار می دهیم تا غده ها رنگ را جذب کنند. در این مرحله باید توجه کنیم که رنگ خشک نشود چون مراحل بعدی را تحت تاثیر قرار خواهد داد. بعد از رنگی شدن غده ها، دوباره با کاغذ صافی همانند مرحله پیش رنگ اضافی را از اطراف نمونه حذف کرده و یک لامل روی نمونه قرار می دهیم. و لام را در قسمت نمونه دارای لامل، لای کاغذ صافی قرار می دهیم. با انگشت شست با چند بار حرکت چرخشی روی نمونه، آنرا Squash کرده تا سلول ها له شده وکروموزوم ها ی پلی تن آنها به خارج سلول انتقال یابد و برای مشاهده مناسب شود. در این مرحله باید دقت لازم بعمل آید تا لامل حین حرکت انگشت جابجا نشود زیرا امکان شکستن کروموزوم ها در این حالت وجو دارد. بعد از این مرحله، لام را با بزگنمایی ۴۰× و ۱۰۰× زیر میکروسکوپ نوری مشاهده و بررسی می کنیم.
بحث و نتیجه گیری:
همانطور که در نتایج حاصل از رنگ آمیزی کروموزوم پلی تن دیده شد، این کروموزوم ها ، کروموزوم های غول پیکری هستند که سلول های خاصی از مگس سرکه وجود دارند. میکرو گراف زیر که توسط B.P.Kaufmann تهیه شده، کروموزوم های پلی تن را در سلول غده ی بزاقی مگس سرکه نشان می دهد.
· هر یک از ۴ جفت کروموزوم مگس، حدود ۱۰ بار همانندسازی مکرر DNA انجام می دهد.
· کروموزوم های همولوگ مادری و پدری و همچنین رشته های ناشی از همانندسازی مکرر با آرایش خاصی در کنار هم ردیف می شوند و نهایتا از ناحیه سانترومری خود به هم متصل می شوند که به این محل تلاقی «کروموسنتر» می گویند.
· در نتیجه هر کروموزوم از یک رشته بسیار ضخیم حاوی ۲۰۴۸ رشته ی مشابه DNA تشکیل شده است.
· این کروموزوم ها آنقدر بزرگ اند که می توان آنها را در طول مدت اینترفاز –حتی با میکروسکوپ نوری کم قدرت-نیز مشاهده کرد.
در واقع، تشکیل این کروموزوم ها ناشی از وقوع مکرر پدیده ی اندومیتوز داخلی است، که در آن DNA در مدت فاز S چرخه ی سلولی همانندسازی کرده اما چرخه سلولی را بطور کامل به اتمام نمی رساند یعنی سیتوکینز صورت نمی گیرد. پدیده آندومیتوز در گیاهان و جانوران مختلف رخ می دهد که بر اساس تفاوت در انجام بعضی مراحل ممکن است انواع گوناگونی را ایجاد کند:
· همانندسازی DNA با تکمیل میتوز اما بدون سیتوکینز
· همانندسازی مکرر DNA بدون تشکیل هسته جدید در تلوفاز. که منجر به یکی از دو حالت زیر می شود:
۱) پلی پلوئیدی: کروموزوم های همانندسازی شده ویژگی های اصلی مربوط به خود را حفظ می کنند.
۲) پلی تنی: کروموزوم های همانندسازی شده به شیوه ای معین در کنار همدیگر قرار گرفته و کروموزوم های غول پیکری را ایجاد می کنند.
۳) ایجاد شرایط متنوع و مختلف بین حالات ۱ و ۲
ویژگی پلی تنی در کروموزوم ها برای موجودات دارای آنها بسیار اهمیت دارد و منجر به افزایش مقادیر ژنی (gene amplification) می شود. داشتن تسخه های متعدد از یک ژن منجر به سطح بالای بیان ژنی می شود، به عبارت دیگر رونویسی و ترجمه به میزان بیشتری رخ می دهد که محصولات ژنی بیشتری را نیز تولید می کند. کروموزوم های پلی تن در همه سلول ها وجود ندارند بلکه در سلول هایی که از نظر متابولیکی فعال و از نظر اندازه بزرگ اند دیده می شوند.
این کروموزوم ها با تو جه به تصاویر حاصله دارای حدود ۵۰۰۰ زیربخش نواری تیره و روشن تقسیم می شوند. ژن ها ی مهم روی هر دو نوار تیره و روشن قرار می گیرند. اما آن دسته از ژن ها که در نواحی روشن قرار دارند فعالیت بیشتری هم دارند. مرز بین نوارهای تیره و روشن دارای عایق های ویژه است.
به علت این که کروموزوم های پلی تن نقش زیادی دز سنتز مولکول ها و پروتئین های موردنیاز موجودات دارند به میزان زیادی عمل رونویسی را انجام می دهند. این عمل در مناطق خاصی از بازو های کروموزومی که تراکم کمتری پیدا می کنند رخ می دهد. این مناطق«پاف» نام دارد. پاف ها فضایی هستند که در آنجا بخشی از تراکم اولیه کروموزومی از بین رفته و محل مناسب فضایی برای فعالیت های آنزیمی ایجاد شده است. بطور کلی، پاف ها در اثر فعالیت ژن های کدکننده عوامل رونویسی ایجاد می شوند. این پروتئین ها بعدا ز تولید به پروموتور های سایر ژن ها متصل شده و آنها را روشن می کند و منجر به ایجاد نواحی پاف در جایگاه های خاص ژنی می شود. . عوامل گوناگونی چون تاثیر بعضی هورمون ها، تغییرات دمایی و … بر تشکیل پاف موثرند و ممکن است آن را تشدید یا تضعیف کنند. پاف ها در روی کروموزوم ها ثابت نیستند بلکه با اتمام رونویسی یا اعمال آنزیمی در طول مدتی از زمان از بین خواهند رفت.








 میکروسکوپ (از یونانی μικρόσκοπεῖν) یا ریزبین دستگاهی است که برای دیدن اجسامی که با چشم مسلح دیده نمیشوند بکار میرود.
میکروسکوپ (از یونانی μικρόσκοπεῖν) یا ریزبین دستگاهی است که برای دیدن اجسامی که با چشم مسلح دیده نمیشوند بکار میرود.


 مقدمه :
مقدمه : میکروارگانیسم ها همانند سایر موجودات زنده برای ادامه زندگی به محیط زیست نیاز دارند که مواد لازم جهت متابولیسم و تکثیر آنها را دارا باشد.ضمنا این محیط باید دارای دما,فشار اسمزی و PH مناسب نیز در حدود ۲/۷ باشد.میکروارگانیسم ها علاوه بر محیط های زیست طبیعی خود توانایی زندگی در محیط های ساخته شده را نیز دارند که آنها را محیط کشت مصنوعی می نامند.
میکروارگانیسم ها همانند سایر موجودات زنده برای ادامه زندگی به محیط زیست نیاز دارند که مواد لازم جهت متابولیسم و تکثیر آنها را دارا باشد.ضمنا این محیط باید دارای دما,فشار اسمزی و PH مناسب نیز در حدود ۲/۷ باشد.میکروارگانیسم ها علاوه بر محیط های زیست طبیعی خود توانایی زندگی در محیط های ساخته شده را نیز دارند که آنها را محیط کشت مصنوعی می نامند.
 زی درباکتری شناسی است که اولین بار توسط کریسین گرم ابداع شد . دراین رنگ آمیزی باکتریها بر مبنای رنگ باکتری پس ازرنگ آمیزی به دودسته گرم مثبت وگرم منفی تقسیم می شوند . رنگ باکتری پس ازرنگ آمیزی به توانایی حفظ رنگ اول وبه عبارتیبه ساختمان دیواره سلولی باکتری بستگی دارد . دررنگ آمیزی گرم باکتریهای گرم مثبت پس ازرنگ آمیزی به رنگ بنفش وباکتری های گرم منفی به رنگ قرمز مشاهده می شود
زی درباکتری شناسی است که اولین بار توسط کریسین گرم ابداع شد . دراین رنگ آمیزی باکتریها بر مبنای رنگ باکتری پس ازرنگ آمیزی به دودسته گرم مثبت وگرم منفی تقسیم می شوند . رنگ باکتری پس ازرنگ آمیزی به توانایی حفظ رنگ اول وبه عبارتیبه ساختمان دیواره سلولی باکتری بستگی دارد . دررنگ آمیزی گرم باکتریهای گرم مثبت پس ازرنگ آمیزی به رنگ بنفش وباکتری های گرم منفی به رنگ قرمز مشاهده می شود




 تئوری آزمایش
تئوری آزمایش و اتر
و اتر  با هم ایزومر گروه عاملی هستند. در ترکیبهایی دیده میشود که یک یا چند لیگاند دارای دو اتم کوئوردیناسیون دهنده باشند، برای مثال یون نیتریک NO-2 میتواند از طریق یک اتم اکسیژن یا از طریق اتم نیتروژن کوئوردیناسیون بدهد. زرد NH3)5CO(NO2)) Cl2)) و قرمز NH3)5-CO-ONO) Cl2))
با هم ایزومر گروه عاملی هستند. در ترکیبهایی دیده میشود که یک یا چند لیگاند دارای دو اتم کوئوردیناسیون دهنده باشند، برای مثال یون نیتریک NO-2 میتواند از طریق یک اتم اکسیژن یا از طریق اتم نیتروژن کوئوردیناسیون بدهد. زرد NH3)5CO(NO2)) Cl2)) و قرمز NH3)5-CO-ONO) Cl2))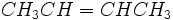


 وبسترا و گزلتن که از کربن حاصل گروه OH می باشد.یک الکل نوع اول دارای ۲ هیدروژن α می باشد و می تواند یکی از آنها را از دست داده و به یک آلدئید تبدیل شود و یا هر دو هیدروژن را از دست داده و به یک کربوکسیلیک اسید تبدیل شود.
وبسترا و گزلتن که از کربن حاصل گروه OH می باشد.یک الکل نوع اول دارای ۲ هیدروژن α می باشد و می تواند یکی از آنها را از دست داده و به یک آلدئید تبدیل شود و یا هر دو هیدروژن را از دست داده و به یک کربوکسیلیک اسید تبدیل شود.


 ن دو قسمت آلی رنگ به عنوان پل عمل میکنند و حداقل یکی از این گروهها آروماتیک هستند. توسط گروه کرموفوری (رنگزای) آزو ، میتوان طیف وسیعی از رنگها مثل زرد ، قرمز ، نارنجی ، آبی ، سبز ، بنفش و سیاه را سنتز کرد.
ن دو قسمت آلی رنگ به عنوان پل عمل میکنند و حداقل یکی از این گروهها آروماتیک هستند. توسط گروه کرموفوری (رنگزای) آزو ، میتوان طیف وسیعی از رنگها مثل زرد ، قرمز ، نارنجی ، آبی ، سبز ، بنفش و سیاه را سنتز کرد.
