تعیین جرم مولکولی اسید آلی مجهول
مقدمه
قبل از تلاش برای تعیین ساختمان یک ماده آلی مجهول از طریق طیف گیری ، میتوان مشکل را با تعیین فرمول مولکولی ماده قدری سادهتر کرد. در این مقاله این موضوع را بررسی میکنیم چگونه فرمول مولکولی یک ترکیب ، تعیین گردیده و چطور میتوان از آن فرمول ، اطلاعاتی برای ساختمان ماده بدست آورد.
تجزیه عنصری و طرز محاسبات
روش قدیمی تعیین فرمول مولکولی یک ماده مستلزم سه مرحله است. اولین مرحله ، انجام آنالیز (تجزیه کیفی عنصری برای یافتن نوع اتمهای موجود در مولکول است. مرحله دوم ، انجام آنالیز کمی عنصری برای یافتن تعداد نسبی انواع مختلف اتمها در مولکول است. این عمل منجر به یافتن فرمول تجربی میگردد. مرحله سوم ، شامل تعیین جرم مولکولی یا تعیین وزن مولکولی است که وقتی آن را با فرمول تجربی در هم آمیزیم، تعداد واقعی اتمهای موجود در مولکول را نشان خواهد داد و نتیجه حاصل ، فرمول مولکولی خواهد بود.
تعیین فرمول تجربی
تقریبا تمام مواد آلی ، دارای کربن و هیدروژن هستند. در اکثر حالتها ، تعیین این که آیا این عناصر موجودند یا خیر ، واجب و لازم نیست. ولی اگر ضرورت ایجاب کند که وجود آن دو را به اثبات رسانیم، میتوان ماده مجهول را در حضور اکسیژن سوزاند. اگر احتراق ماده ، انیدریک ایجاد کند، پس در ماده مجهول کربن موجود بوده است و اگر آب ایجاد شد، میبایست اتمهای هیدروژن در ماده وجود داشته باشند.
یادآوری این نکته ضروری است که هیچ روش مستقیم مناسبی برای تعیین وجود اکسیژن در یک ماده وجود ندارد، به این دلیل است که در آنالیز کیفی از اکسیژن نامی برده نمیشود. نیتروژن ، کلر ، برم ، ید و گوگرد را میتوان به آزمایشی مشابه آزمون ذوب سدیم شناسایی کرد.
برای تعیین دقیق کربن و هیدروژن موجود در یک ماده مجهول ، به یک آنالیز کمی نیاز است. در عملیات آزمایشگاهی تجاری مکررا این تجزیه را انجام میدهند. روش تعیین مقادیر کربن و هیدروژن در یک ماده ، مبتنی بر احتراق آن برای تولید انیدریک کربنیک و آب است. در تجزیه کمی ، انیدریک کربنیک و آب را جمعآوری کرده و سپس وزن میکنیم. روشهایی نیز برای تعیین مقادیر گوگرد ، نیتروژن و هالوژنهای موجود در ترکیب در دسترس هستند.
تعیین جرم مولکولی
یک مرحله در تعیین فرمول مولکولی یک ماده ، تعیین وزن یک مول از آن ماده است. این عمل به طرق مختلفی صورت میگیرد. بدون در دست داشتن جرم مولکولی یک مجهول ، کسی قادر نیست بگوید فرمول تجربی که مستقیم از تجزیه عنصری تعیین گشته ، آیا فرمول حقیقی ماده بوده یا این که این فرمول باید در عددی ضرب شود تا فرمول مولکولی واقعی جسم مجهول مشخص گردد.
استفاده از طیف سنج جرمی
در یک آزمایشگاه جدید ، جرم مولکولی با استفاده از طیف سنج جرمی تعیین میگردد. یک روش قدیمی جهت تعیین جرم مولکولی ماده ( بر اساس اصول شیمی عمومی ) ، روش چگالی بخار است. در این روش ، حجم مشخصی از گاز در دمای مشخص توزین میگردد. پس از تبدیل حجم گاز در دما و فشار استاندارد ، میتوان تعیین نمود که آن حجم چه کسری از یک مول را نشان میدهد. از این طریق میتوان جرم مولکولی ماده را بسادگی تعیین کرد.
اندازهگیری نزول نقطه انجماد یک حلال
روش دیگر تعیین جرم مولکولی یک ماده ، اندازهگیری نزول نقطه انجماد یک حلال است که به مقدار مشخصی از ماده مورد آزمایش اضافه شده باشد. این روش به نام روش انجماد سنجی خوانده میشود.
اسمومتری فشار بخار
روش دیگر که فقط گاهی اوقات مورد استفاده قرار میگیرد، اسمومتری فشار بخار است. در این روش ، ماده مورد آزمایش را در یک حلال حل کرده و تغییر فشار بخار حلال را اندازه میگیرند.
تیتراسیون
اگر ماده مجهول یک اسید کربوکسیلیک باشد، میتوان آن را با محلول استاندارد هیدروکسید تیتر کرد. با بهره گیری از این روش میتوان اکیوالان خنثی را تعیین نمود. اکیوالان خنثی معادل وزن اکیوالان آن اسید است. اگر آن اسید فقط حاوی یک گروه کربوکسیل باشد، در آن صورت اکیوالان خنثی و جرم مولکولی معادل خواهند بود. اگر آن اسید دارای بیش از یک گروه کربوکسیل باشد، آنگاه اکیوالان خنثی برابر جرم مولکولی اسید تقسیم بر تعداد گروههای کربوکسیل خواهد بود. بسیاری از فنلها (بویژه آنهایی که توسط گروههای الکترون کشنده استخلاف شدهاند) آنقدر اسیدیاند که میتوان آنها را با روشی مشابه اسیدهای کربوکسیلیک تیتر کرد. این روش را میتوان برای اسیدهای سولفونیک نیز بکار برد.
فرمول مولکولی
هنگامی که جرم مولکولی و فرمول تجربی تعیین گردیدند، میتوان مستقیما فرمولی مولکولی جسم را تعیین کرد. اغلب ، وزن فرمول تجربی و جرم مولکولی یکسان است. در چنین حالتی ، فرمول تجربی ، همان فرمول مولکولی است. در بسیاری از حالتها وزن فرمول تجربی کمتر از جرم مولکولی است. در چنینی حالتهایی ضروری است که تعیین گردد چند بار وزن مولکولی را باید به وزن فرمول تجربی تقسیم کرد و سپس رقم بدست آمده را در فرمو ل تجربی ضرب کرد تا فرمول مولکولی بدست آید.
مثال ساده در این مورد ، اتان است. بعد از تجزیه کمی عنصری ، فرمول تجربی CH3 برای اتان تعیین گردید. محاسبات نشان داد که جرم مولکولی اتان ۳۰ است. پس از تقسیم وزن مولکولی اتان (۳۰) بر وزن فرمول تجربی (۱۵) رقم ۲ بدست آمد. بنابراین ، باید فرمول مولکولی اتان ، ۲(CH3) یا C2H6 باشد.
برای مثال ، مجهولی که پیشتر در این فصل معرفی گشت، فرمول تجربی C7H14O2 بوده و وزن فرمولی آن ۱۳۰ است. اگر فرض کنیم که جرم مولکولی این ماده ۱۳۰ تعیین شده است، میتوان نتیجه گرفت فرمول تجربی و فرمول مولکولی معادلند و ضمنا فرمول مولکولی باید C7H14O2 باشد.
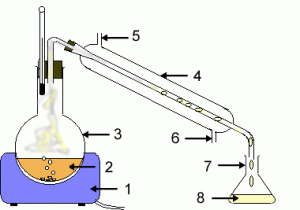
روش کار : ۰٫۰۲g اسید مجهول وزنی را وزن می کنیم و بعد آن را در ۱۰cc الکل سفید حل می کنیم و بعد به آن ۴۰cc آب مقطر می افزاییم و در قسمت آخر به آن ، به مقدار ۲ قطره شناساگر فنل فتالئین می افزاییم فنل فتالئین در محیط اسیدی بی رنگ است و در محیط بازی به بنفش است .
بعد از تهیه آن محلول به مرحله تهیه ی ۱۰۰cc محلول NaOH 0.1M تهیه می کنیم و در داخل بورت می ریزیم و مرحله ی بعدی مرحله ی انجام تیتراسیون است که آن را نیز انجام می دهیم و به محض اینکه رنگ محلول به رنگ بنفش می رسد شیر بورت را می بندیم و بعد جرم مولکولی اسید مجهول را به دست می آوریم

 وبسترا و گزلتن که از کربن حاصل گروه OH می باشد.یک الکل نوع اول دارای ۲ هیدروژن α می باشد و می تواند یکی از آنها را از دست داده و به یک آلدئید تبدیل شود و یا هر دو هیدروژن را از دست داده و به یک کربوکسیلیک اسید تبدیل شود.
وبسترا و گزلتن که از کربن حاصل گروه OH می باشد.یک الکل نوع اول دارای ۲ هیدروژن α می باشد و می تواند یکی از آنها را از دست داده و به یک آلدئید تبدیل شود و یا هر دو هیدروژن را از دست داده و به یک کربوکسیلیک اسید تبدیل شود.


 ن دو قسمت آلی رنگ به عنوان پل عمل میکنند و حداقل یکی از این گروهها آروماتیک هستند. توسط گروه کرموفوری (رنگزای) آزو ، میتوان طیف وسیعی از رنگها مثل زرد ، قرمز ، نارنجی ، آبی ، سبز ، بنفش و سیاه را سنتز کرد.
ن دو قسمت آلی رنگ به عنوان پل عمل میکنند و حداقل یکی از این گروهها آروماتیک هستند. توسط گروه کرموفوری (رنگزای) آزو ، میتوان طیف وسیعی از رنگها مثل زرد ، قرمز ، نارنجی ، آبی ، سبز ، بنفش و سیاه را سنتز کرد.