میکروب ها باهوش هستند

میکروب ها باهوش هستند
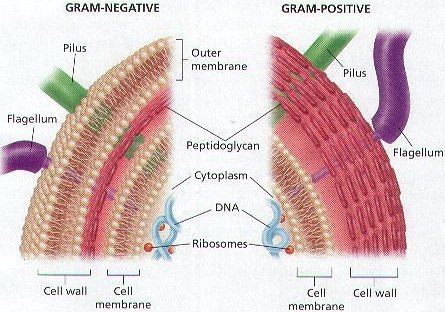
بسیاری از باکتری ها و آغازیان رفتارهای هوشمندانه و قابل ملاحظه ای از خود نشان می دهند. این رفتارهای هوشمندانه، از آن نوع که در انسان و یا سایر موجودات پیچیده می بینیم، نمی باشد چرا که موجودات تک سلولی نه تنها مغز، بلکه سیستم عصبی هم ندارند. به عبارت دیگر آنها کامپیوترهای زیستی هستند که می تواند اطلاعات را پردازش کند. در این مطلب به چندین مثال برجسته از این رفتارهای هوشمند اشاره می کنیم. بخش اعظم گونه های موجود بر روی زمین تک سلولی هستند. بسیاری از این موجودات تک سلولی تا کنون شناخته نشده اند و بسیاری از آنهایی هم که شناسایی شده اند، نام گذاری نشده اند. اما بخش کوچکی از گونه های تک سلولی که تا به حال مورد مطالعه قرار گرفته اند، توانایی های قابل ملاحظه ای از خود نشان داده اند. بسیاری از این توانایی ها فیزیکی هستند؛ به طور مثال، برخی از آنها می توانند برای صدها هزار سال غیر فعال باشند و یا در محیطی رشد کنند که سایر میکروارگانیسم ها بلافاصله در آن از بین می روند. بسیاری از باکتری ها و آغازیان رفتارهای هوشمندانه و قابل ملاحظه ای از خود نشان می دهند و به نظر می آید آنها کامپیوترهای زیستی هستند که می تواند اطلاعات را پردازش کند. در اینجا به چندین مثال برجسته از این رفتارهای هوشمند اشاره می کنیم. ارتباطات باکتری ها بوسیله مواد شیمیایی با یکدیگر ارتباط برقرار می کنند. آنها این کار را به دلایل مختلفی انجام می دهند که درک آن مشکل است. یکی از ساده ترین این باکتری ها باسیلوس سوبتیلیس می باشد. اگر باسیلوس سوبتیلیس در محیط فقیر مواد غذایی رشد کند، ماده شیمیایی خاصی به اطراف خود ترشح می کند. این ماده به باکتری های اطراف می گوید “غذای کافی اینجا وجود ندارد، از اینجا بروید وگرنه هردو از گرسنگی خواهیم مرد”. در جواب به پیغام این مواد شیمیایی، سایر باکتری ها با فاصله از یکدیگر قرار گرفته و شکل کلنی ها کاملا تغییر می کند. تصمیم گیری بسیاری از موجودات تک سلولی، قادر به شناسایی تعداد باکتری های هم گونه خود که در نزدیکی آنها قرار دارند هستند. این توانایی به “حس حد نصاب” (quorum sensing) معروف است. هر باکتری مقدار کمی از یک ماده شیمیایی را به محیط اطرافش ترشح می کند که می تواند توسط گیرنده¬های موجود در دیواره سلولی آنها تشخیص داده شود. اگر تعداد زیادی باکتری در محیط باشد، تمام باکتری ها یک نوع ماده شیمیایی ترشح کرده و میزان این ماده شیمیایی به نقطه بحرانی رسیده و سبب تغییر در رفتار باکتری ها می شود. باکتری های بیماری زا اغلب با استفاده از این حس، تصمیم می گیرند چه زمانی به میزبان خود حمله کنند. زمانی که به تعداد کافی برای فشار به سیستم ایمنی تکثیر شدند، به صورت دسته جمعی حمله به موجود میزبان را آغاز می کنند. بنابراین، به نظر می آید با جلوگیری از انتقال علائم بین این باکتری ها می توان راهی را برای مقابله با آنها پیدا کرد. شهر نشینی (تشکیل جوامع باکتریایی) باکتری ها نه تنها می توانند با یکدیگر ارتباط برقرار کنند و با هم همکاری داشته باشند بلکه می توانند تشکیل جوامعی را بدهند. نتیجه این کار، بیوفیلم یا همان لایه های نازک لعابی شکل داخل لوله های آب، یا سطوح آشپزخانه در خانه های دانشجویی(!) می باشد. آنها همچنین در پناهگاه های زیستی مانند لایه داخلی دستگاه گوارش انسان و یا هرجایی که آب وجود داشته باشد یافت می شوند. بسیاری از گونه ها در کنار یکدیگر در “شهرهای باکتریایی” از مواد زائد یکدیگر استفاده می کنند و از منابع غذایی با همکاری یکدیگر بهره برداری کرده و از یکدیگر در مقابل خطرات خارجی مانند آنتی بیوتیک ها محافظت می نمایند. تسریع در جهش زایی بسیاری از میکروب ها قادر به سرعت بخشیدن به میزان جهش در ژن های خود هستند. این امر به آنها توانایی های جدیدی می بخشد که می تواند برای شرایط سخت مفید باشد. این امر از آنجایی که بسیاری از جهش ها مضر و حتی کشنده می باشند، برای باکتری خطرساز است و به عنوان آخرین راه حل و زمانی که چیز زیادی برای از دست دادن باقی نمانده است، استفاده می شود. مثال های زیادی در این زمینه وجود دارند: اشریشیا کلی بسیار سریع تر در شرایط استرس جهش می یابد و نشان داده شده است که مخمر هم از همین ترفند استفاده می کند. در اوایل دهه ۹۰ میلادی، محققین پیشنهاد دادند که باکتری ها ممکن است راه خاصی برای انتخاب جهش ها داشته باشند. در این زمینه ایده جهش مستقیم (directed mutation) بسیار بحث برانگیز بود. جهت یابی بسیاری از جانوران می توانند از فواصل زیادی راه خود را پیدا کنند. پرنده هایی که کوچ می کنند و زنبور عسل بهترین مثال ها برای این پدیده هستند. میکروب ها نیز در این زمینه تبحر دارند. جلبک های تک سلولی که به شکل دسته جمعی کلامیدوموناس نام دارند، به سمت نور شنا می کنند البته فقط زمانی که آن نور در طول موجی باشد که آنها برای فتوسنتز از آن استفاده می کنند. مشابه جلبک های تک سلولی، بعضی از باکتری ها به سمت مواد شیمیایی که در محیطشان وجود دارد، حرکت می کنند که به این رفتار کموتاکسیس می گویند. برای مثال اشریشیا کلی همانند کوسه ای که رد خون را می گیرد، اگر حتی مولکول های اندکی از غذا وارد محیط اطرافش شود، به سمت آن حرکت می کند. گروه دیگری از باکتری ها به طرف نیروی مغناطیسی زمین به گونه ای صف می شوند که قادر به حرکت مستقیم به سمت شمال یا جنوب شوند. این باکتری ها که معروف به باکتری های مغناطیسی هستند، این توانایی ویژه را از اندامک های پوشیده شده از کریستال های مغناطیسی خود کسب نموده اند. اما شاید بهترین مثال از جهت یابی میکروب ها، کپک پلی سفالوم (Physarum polycephalum) باشد. کلنی های شبه آمیب این موجود، همیشه کوتاهترین راه را در یک مسیر پیچیده انتخاب می کنند. یادگیری و حافظه وقتی آمیب Dictyostelium سطحی را برای غذا جستجو می کند، گاهی تغییر مسیر داده و بر می گردد ولی این تغییر مسیرهایش تصادفی نمی باشد. این موجود با تغییر جهت های هدفمند، آخرین چرخش خود در مسیر را به خاطر می سپارد. اسپرم انسان نیز دارای چنین توانایی می باشد. اشریشیا کلی حتی بهتر از این عمل می کند. این باکتری بخشی از چرخه زندگی خودش را صرف گشت و گذار در دستگاه گوارش و روبرو شدن با محیط های مختلف می کند. در طی این مدت، با قند لاکتوز قبل از یافتن قند مرتبط با آن یعنی مالتوز مواجه می شود. در مواجهه با لاکتوز، سازوکار بیوشمیایی تجزیه این قند فعال می شود اما در همین حال، سیستم تجزیه مالتوز نیز تا حدودی فعال می شود تا برای مرحله بعد که برخورد با مالتوز می باشد، آماده باشد. اما در تحقیقات دانشمندان اسرائیلی، پژوهشگران این باکتری را برای چندین ماه در محیط کشت واجد لاکتوز و بدون مالتوز، رشد دادند. آنها متوجه شدند که این باکتری به تدریج رفتارش را تغییر داده و تمایلی به فعال کردن سیستم تجزیه مالتوز نشان نمی دهد. ترجمه: سمانه مفاخری ویرایش: کسری اصفهانی منبع: نیوساینتیست