استخراج ” آزمایشگاه شیمی آلی”
استخراج روشی است برای جداسازی که مستلزم انتقال جسمی از یک فاز به فاز دیگر است.این روش بر مبنای پخش فاز بنا نهاده شده است .جسم می تواند در بین دو فاز نامحلولی که با آنها در تماس است پخش متعادلی پیدا کند و نسبت این تعادل بستگی به پایداری نسبی جسم در هر یک از دو فاز دارد.زمانی که دو فاز مایعات مخلوط نشدنی باشند روش استخراج مایع – مایع نامیده می شود.
الف.استخراج مایع – مایع
در بعضی مواقع لازم است برای بازیابی یک جسم آلی از محلول آبی از روش غیر از تقطیر استفاده می شود.یکی از این راه ها تماس دادن محلول آبی با یک حلال غیر قابل امتزاج با آب است.اگر حلال خاصیت جدا سازی را داشته باشد بیشتر مواد آلی از لایه آبی به حلال آلی (غیر قابل امتزاج با آب ) انتقال پیدا می کند.
این روش را که ” جسم حل شده در آب به وسیله یک حلال آلی دیگر جدا می شود ” استخراج می نامند.یکی از خواص حلال که برای استخراج به کار برده می شود این است که قابلیت حل شدن آن در آب یا هر ماده دیگری که جسم آلی را در خود حل کرده کم باشد و یا اصلا حل نشود.همچنین باید فرار باشد تا به راحتی بتوان آن را از ترکیب یا ترکیبات آلی استخراج شده جدا کرد.
بنابراین جسم استخراج شونده باید در حلال استخراج کننده به خوبی حل شود و قابلیت انحلال در این حلال بسیار بیشتر از آب باشد,ضمن اینکه حلال استخراج کننده نباید هیچ واکنشی با آب و یا مواد قابل استخراج بدهد.
برای انتخاب حلال مناسب برای استخراج بررسی هایی مشابه آنچه که در بلور گیری انجام می دهند لازم است
۱-به خوبی جسم مورد استخراج را در خود حل کند (ضریب توزیع مناسب داشته باشد )
۲-حلالیت آن در حلال جسم مورد نظر کم باشد
۳-نا خالصی ها و یا اجسام دیگر موجود را خیلی کم و یا اصلا استخراج نکند
۴-به سهولت بتوان آن را پس از عمل استخراج شده جدا کرد
۵-واکنش شیمیایی با جسم حل شونده نداشته باشد
ساده ترین حالت استخراج آن است که جسم در دو حلال غیر قابل اختلاط پخش شود.از نظر کمی این پخش را بر حسب ضریب پخش یا توزیع بیان می کنند.در محلول های رقیق یک جسم بین دو حلال غیر قابل امتزاج توزیع می شود تا اینکه نسبت غلظت در یک حلال به غلظت در حلال دیگر عدد ثابتی باشد.
حل شدن ماده استخراجی در هر فاز به دو مورد بستگی دارد:
۱-به قابلیت حل شدن ماده استخراج شونده ۲-به حجم هر فاز
اثر نمک روی حلالیت
حلالیت اجسام آلی در آب به طور مؤثری توسط حضور نمک های معدنی حل شده تحت تأثیر قرار می گیرند.برای مثال اتانول که به طور کامل با آب خالص قابل امتزاج است فقط به طور جزئی در محلول های مائی قوی از سدیم کلرید , پتاسیم کربنات و برخی دیگر از نمک های معدنی معین حل می شوند.
این پدیده که از اثر نمک در خارج سازی جسم به وجود می آید به طور متداول با نمک های دارای یون های با شعاع کوچک و بار متمرکز اتفاق می افتد افزایش نمک دو اثر دارد:
الف)حلالیت حلال در آب کم می شود
ب)حلالیت ماده جامد آلی در آب کم می شود
روش استفاده از قیف جدا کننده یا دکانتور
استخراج در کارهای آزمایشگاهی توسط تکان دادن محلول مورد استخراج با حلال درون قیف جدا کننده شیشه ای صورت می گیرد.قیف کشیده مخروطی شکل با دنباله کوتاه برای این منظور به کار می برند قیف حاوی مخلوط را خوب تکان دهید تا تمام مایعات غیر قابل حل به صورت فیزیکی مخلوط شوند,سپس آن را روی پایه ای به حال خود بگذارید تا لایه ها به به طور کامل از هم جدا شوند.به هم زدن شدید مخلوط ها وقتی دلخواه بوده که تولید امولسیون نکند.,زیرا بعدا برای برای جداسازی لایه ها به مزاحمت بر میخوریم.در چنین مواقعی بهتر است لایه ها را خیلی ملایم به هم زد.در ضمن به هم زدن یک دست را باید روی سر قیف و دست دیگر را روی شیر قیف قرار داد تا سر و شیر قیف محکم در جای خود نگه داشته شوند.فشار درون قیف را گاهی با معکوس نگه داشتن (دنباله قیف به طرف بالا) و یک لحظه باز کردن شیر کاهش می دهند.این عمل به ویژه زمانی مهم است که از حلال بسیار فرار نظیر اتر استفاده شود.
احتیاط:دنباله قیف جدا کننده را در موقع کاهش فشار درون آن نباید به طرف افراد دیگر قرار داد زیرا در این زمان قطراتی از مایع درون دنباله قیف با فشار خارج می شود.
در زمان جدا کردن مایعات سر قیف را باید سست کرد و یا برداشت,سپس لایه پایینی را به دقت درون ارلن مایر ریخت ضمنا باید شیر قیف را با دو دست نگه داشت تا از سست شدن آن و هدر رفتن مایع جلوگیری کرد .اگر ماده درون قیف خاصیت خورندگی داشته و یا ارزشمند باشد در عمل بهتر است که یک بشر را زیر قیف قرار داده و سپس قیف را برای هر مدتی که لازم است به حال خود باقی گذاشت اگر فقط یک لایه باید نگه داری شود لازم است دو لایه را تا زمانی که اطمینان کامل حاصل نشده که کدامیک حاوی ماده دلخواه است نگه داری کرد.
همانگونه که مرز دو مایع به نزدیکی شیر قیف برسد سرعت خارج شدن مایع از قیف را باید کاهش داد.پس از اینکه جداسازی انجام شد شیر را بسته و محتویات قیف را به آهستگی به چرخش درمی آورندتا قطرات مایع سنگین تر از درون یک ظرف تمیز می ریزند.لایه بالایی نباید از شیر قیف خالی شود زیرا منجر به آلوده شدن آن با لایه اول که درون دنباله قیف وجود دارد می شود.لایه آلی را معمولا با افزایش معرف خشک کننده جامد از آب جدا می کنند و حلال را به وسیله عمل تقطیر حذف می کنند.
در هر بار استفاده از قیف شیر آن را باید با ماده چرب کننده روان کرد تا ضمن کار با قیف شیر آن محکم نشود و یا مایع قیف نشست ندهد.پس از استفاده از قیف جداکننده باید آن را کاملا تمیز و شیر آن را مجددا چرب کرد تا در یک موقعیت محکم نشود و بعدا به سهولت بتوان آن را باز کرد.اگر از مواد سیلیکون دار برای روان کردن شیر استفاده می کنید باید قبل از تمیز کردن قیف ماده روان کننده را با مخلوط اکسنده از سطح شیشه زدود تا لایه نازک سیلیس روی شیشه به وجود نیاید.مسئله محکم شدن شیر قیف های جدا کننده آن قدر جدی است که بسیاری ترجیح می دهند که قطعات قیف ها را به صورت جدا از هم نگه داری کنند.برای باز کردن شیرهایی که محکم شده اند قسمت خارجی شیر یا بدنه قیف را به وسیله بخار آب گرم می کنند.در همین زمان فشار کمی به شیر وارد می آید و آن را باز می کنند ( در ضمن برای محافظت انگشتان باید از حوله استفاده کرد)
شرح آزمایش:
مقدار ۲۰ میلی لیتر کلروفرم که مقداری آلودگی اسیدی دارد داخل قیف دکانتور ریخته و سپس ۱۰ میلی لیترمحلول ۱۰% سدیم کربنات به آن اضافه کنید در اثر این افزودن مقداری گاز دی اکسید کربن تولید شده که با باز کردن شیر دکانتور خارج می شود حال قیف را به روی خلقه قرار داده و در آن باز کنید بعد از جدا شدن کامل دو فاز فاز زیری که کلروفرم می باشد را داخل بشری جمع آوری نمایید و برای گرفتن آب به آن مقداری کلرید کلسیم به عنوان خشک کننده اضافه کنید و بعد در داخل ارلن تمیز و خشک با یک قیف شیشه ای کاملا خشک و صاف کنید و محلول به دست آمده را به مسئول آزمایشگاه تحویل دهید
استخراج از جامدها:
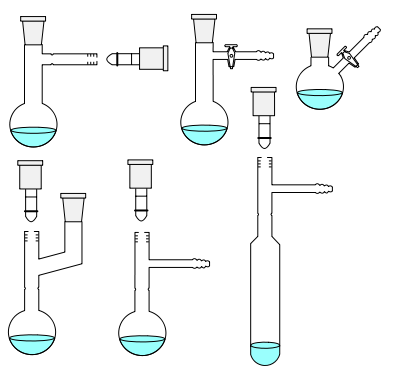
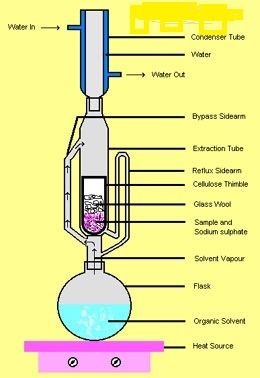
استخراج آلکالوئیدها از برگها و ساقه ها ,عصاره های معطر از بذرها ,اسانس عطر از گلها و قند از نیشکر اولین نمونه برای عمل استخراج است .حلال های متداول که برای این منظور به کار گرفته می شوند اتر ,متیلن کلرید ,کلروفرم ,استون , انواع الکل ها و آب هستند دستگاه متداول برای استخراج مداوم از جامدات توسط حلال های فرار به نام استخراج کننده سوکسله میباشد.
بخارات حاصل از حلال در حال جوش که درون فلاسک است از لوله عمودی سمت چپ به داخل مبرد بالای دستگاه می رسد مایع متراکم شده که به داخل انگشتانه ای جامدی قرار گرفته است که می بایست استخراج شود محلول محتوی جسم استخراج شده از جامد از خلل و فرج کاغذ صافی انگشتانه ای به خارج نشست یافته و زمانی که لوله سیفون سمت راست پر شود به داخل فلاسک حلال برگردانده می شود درون این دستگاه عمل سیفون به طورمتناوب اتفاق می افتد مایع به فلاسک برنمی گردد تا اینکه سطح مایع درون انگشتانه به قسمت بالای لوله سیفون برسد.هر وقت تمامی مایع درون سیفون و انگشتانه خارج شود,دوباره چرخه پر و خالی شدن سیفون از سر گرفته می شود.
در استخراج جامد-مایع بازده جداسازی به حلالیت ترکیب مورد نظر در حلال استخراج کننده به حجم حلال مورد استفاده و به تعداد دفعاتی که عمل استخراج تکرار می شود بستگی دارد.
عواملی که باعث کاهش بازده استخراج جامد-مایع می شوند عبارتند از : درشتی ذرات مخلوط جامد ,زمان کم تماس حلال با جامد و خوب مخلوط نکردن حلال و جامد.
شرح آزمایش:
۲۵ گرم چای خشک , ۲۵ گرم کربنات کلسیم و ۲۵۰ میلی لیتر آب مقطر را در یک بالن مجهز به مبرد بریزید و بالن را به مدت ۲۰ دقیقه در شعله حرارت دهید تا رفلاکس انجام گیرد زمانی که محلول داغ است آن را توسط کاغذ صافی صاف کنید اگر حرکت محلول در کاغذ صافی کند شد آن را عوض کنید پس از این اعمال مایع زیر صافی را در حرارت اتاق سرد کرده و دوباره آن را با ۲۵ میلی لیتر کلروفرم توسط قیف جدا کننده استخراج کنید .توجه داشته باشید که دکانته کردن به مدت ۵ الی ۸ دقیقه انجام گیرد و به هیچوجه شدیداً هم زده نشود زیرا تولید امولسیون می کند برای این منظور خیلی آهسته چند بار قیف را وارونه و سپس به جای خود برگردانید سپس اجزای استخراج شده را که لایه زیر می باشد در یک ارلن ریخته و توسط تبخیر کلروفرم کافئین را به صورت پودر جمع آوری کند.
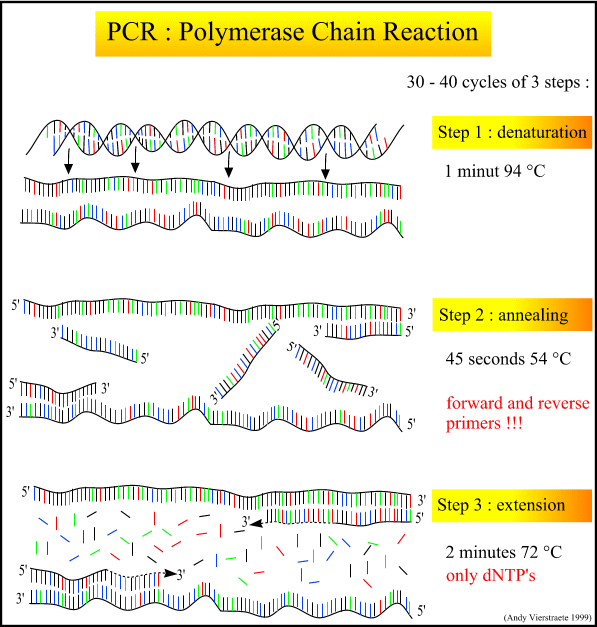 PCR یا واکنش زنجیره ای پلیمراز (Polymerase Chain Reaction)، تکنیکی است که با استفاده از آن می توان در مدت زمان کوتاهی قطعه خاصی از مولکول DNA را در شرایط آزمایشگاهی میلیون ها بار تکثیر نمود. این قطعه DNA ممکن است یک ژن، بخشی از یک کروموزوم یا بخش هایی از ژنوم یک موجود باشد. البته در تکثیر DNA با روش PCR محدودیت هایی نیز وجود دارد که مهمترین آنها اندازه قطعات قابل تکثیر می باشد به طوری که حداکثر اندازه قطعه هایی که با روش PCR معمولی تکثیر می گردد، ۵ هزار نوکلئوتید (kb 5) و در روش های بهینه شده تا ۲۰ هزار نوکلئوتید (kb 20) می باشد. با این تعریف، PCR همانند یک دستگاه فتوکپی عمل می کند که بوسیله آن می توان صفحاتی از کتاب ژنوم هر موجود را به تعداد دلخواه و مشابه نسخه اصلی (البته در مواردی همراه با خطاهای جزئی) تکثیر نمود. اساس این روش بسیار ساده بوده و مانند واکنش همانندسازی DNA در موجودات زنده توسط آنزیم DNA پلیمراز صورت می گیرد. در موجودات زنده، مجموعه ای از چند پروتئین و آنزیم در فرآیند همانند سازی DNA نقش دارند در حالی که در واکنش PCR تنها نوع خاصی آنزیم DNA پلیمراز مقاوم به حرارت به نام Taq polymerase به همراه بافر، کلرید منیزیم و نوکلئوتیدها جهت تکثیر قطعات DNA استفاده می شود. مخترع واکنش PCR کَری مولیس (Kary Mullis) می باشد که در سال ۱۹۸۳ این روش را جهت تکثیر DNA معرفی کرد. قبل از این کشف، ساخت قطعات DNA با روش های کند و پر هزینه شیمیایی انجام می گرفت. به دلیل اهمیت این اختراع، کاربردهای فراوان و نقش ارزنده آن در پیشرفت علم ژنتیک و زیست شناسی مولکولی، وی جایزه نوبل شیمی را در سال ۱۹۹۳ دریافت کرد. واکنش PCR به طور روزمره در اکثر آزمایشگاه های تشخیصی و تحقیقاتی استفاده می شود و در موارد بسیاری مثل شناسایی و جداسازی ژن ها، کلونینگ، طبقه بندی و شناسایی موجودات زنده، تشخیص بیماری های ژنتیکی و حتی پرونده های جنایی و تعیین هویت کاربرد دارد. در حال حاضر و نزدیک به ۳۰ سال پس از کشف PCR، تحقیقات ژنتیک مولکولی بدون استفاده از این تکنیک قابل تصور نیست. سازوکار (برنامه) واکنش PCR اساس واکنش PCR جهت تکثیر توالی DNA دو رشته ای، تغییرات دمایی می باشد. در ابتدا پیوندهای هیدروژنی دو رشته توالی DNA با حرارت (۹۴-۹۵ درجه سلسیوس) شکسته و دو رشته از یکدیگر جدا می شوند. سپس دمای واکنش پایین آورده می شود (معمولاً ۵۰ تا ۶۰ درجه سلسیوس). در این مرحله، دو قطعه کوتاه DNA تک رشته ای (معمولاً بین ۱۸ تا ۳۰ نوکلئوتید) که دقیقاً مشابه دو طرف قطعه DNA مورد نظر برای تکثیر طراحی و ساخته شده اند (با نام پرایمر یا آغازگر)، به توالی های مکمل خود در دو رشته باز شده DNA متصل می گردند. این دو قطعه انتهای ۳’ آزاد جهت فعالیت آنزیم DNA پلیمراز را فراهم می نماید، کاری که در همانند سازی در موجودات زنده توسط آنزیم پریماز و توالی اولیه ساخته شده توسط آن انجام می گیرد. در مرحله بعد، دمای واکنش تا ۷۲ درجه سلسیوس (دمای مناسب آنزیم Taq polymerase) افزایش یافته و عمل تکثیر قطعه DNA مورد نظر بین دو پرایمر با استفاده از نوکلئوتیدهای موجود، توسط آنزیم Taq polymerase مقاوم به حرارت انجام می پذیرد. این ۳ مرحله بین ۲۵ تا ۴۰ بار تکرار می شود که به آن چرخه های PCR می گویند. مرحله اول: واسرشت سازی (Denaturation)، ۳۰ تا ۶۰ ثانیه عمل انجام شده در این مرحله: جدا شدن دو رشته DNA مرحله دوم: اتصال (Annealing)، ۳۰ تا ۶۰ ثانیه عمل انجام شده در این مرحله: اتصال پرایمرها به نواحی مکمل روی DNA و تعیین محدوده تکثیر قطعه DNA مرحله سوم: گسترش (Extension یا Elongation)، به ازای هر ۱۰۰۰ نوکلئوتید طول قطعه ۶۰ ثانیه عمل انجام شده در این مرحله: تکثیر قطعه DNA مورد نظر اجزا واکنش PCR در یک واکنش PCR از نمونه DNA، آنزیم Taq polymerase، پرایمرها، بافر، یون منیزیم، نوکلئوتیدها و آب حضور استفاده می شود. توضیحات مربوط به هر یک از این اجزا در ادامه ارائه شده است: - نمونه DNA (الگو) تکثیر از روی نمونه DNA انجام می شود. این نمونه می تواند، قطعه ای DNA، محصول استخراج DNA ژنومی، DNA پلاسمیدی یا حتی محصول PCR دیگری باشد. معمولاً حدود یک نانوگرم از DNA پلاسمیدی یا فاژی یا یک میکروگرم از DNA ژنومی برای یک واکنش PCR کافی است. بیش از این مقدار، باعث تولید محصولات غیر اختصاصی (قطعات DNA دیگری غیر از قطعه مورد نظر) شده و مقدار کم نمونه DNA نیز باعث کاهش دقت واکنش PCR یا عدم تکثیر قطعه مورد نظر می گردد. کیفیت نمونه DNA نیز مهم است به طوری که باقی ماندن ترکیبات مورد استفاده در مرحله استخراج DNA مثل فنل و EDTA، باعث کاهش فعالیت آنزیم Taq polymerase و عدم حصول نتیجه مورد نظر می گردد. همچنین آلوده شدن واکنش PCR با مقادیر بسیار اندک DNA از هر منبع دیگری، به دلیل حساسیت فوق العاده این تکنیک، ممکن است به تولید قطعات غیر قابل انتظار بیانجامد. - آنزیم Taq polymerase این آنزیم برای تکثیر قطعات کمتر از سه هزار جفت باز توصیه شده و پر مصرف ترین آنزیم مورد استفاده در PCR می باشد. به طور معمول حدود یک واحد از این آنزیم در ۵۰ میکرو لیتر از واکنش PCR استفاده می شود. اگر نمونه DNA حاوی مواد ممانعت کننده PCR باشد، می توان این مقدار را دو تا سه برابر افزایش داد ولی مقادیر بالاتر آنزیم باعث تولید محصولات غیر اختصاصی می گردد. گرچه دمای مناسب برای این آنزیم ۷۲ درجه سلسیوس می باشد ولی چون این آنزیم در دمای معمولی نیز قادر به تکثیر می باشد برای جلوگیری از اتصال قطعات پرایمر به نقاط دیگری روی توالی نمونه DNA و امکان تولید قطعات غیر اختصاصی، توصیه می شود که تمامی مراحل آماده سازی واکنش PCR بر روی یخ صورت گیرد. - نوکلئوتید ها چهار نوکلئوتید تشکیل دهنده قطعه DNA از اجزا واکنش PCR می باشند که به عنوان واحد های ساختمانی مورد نیاز در ساخت قطعه DNA استفاده می شوند. غلظت مورد نیاز از هر یک از نوکلئوتیدها برای واکنش PCR یکسان و برابر ۲۰۰ نانو مولار می باشد. برای این منظور از مخلوط های آماده واجد هر چهار نوکلئوتید که با غلظت های مختلف مثل دو میلی مولار، ۱۰ میلی مولار و ۲۵ میلی مولار موجود است، استفاده می شود. به طور مثال، در یک واکنش ۵۰ میکرو لیتری PCR باید ۵ میکرو لیتر از مخلوط دو میلی مولار نوکلئوتیدها برای دستیابی به مقدار مورد نیاز در واکنش استفاده کرد. - بافر مهمترین نقش بافر PCR تنظیم pH مناسب واکنش PCR و آنزیم Taq polymerase می باشد. اجزای این بافر نقش های دیگری نیز دارند از جمله کلرید پتاسیم که به اتصال پرایمر به DNA الگو (نمونه) کمک می کند. - یون منیزیم یون منیزیم یکی از اساسی ترین اجزا واکنش PCR می باشد. انواع مختلف آنزیم DNA polymerase برای فعالیت خود به این یون نیاز دارند و این یون برای اتصال پرایمر و قطعه DNA لازم است. برای تکثیر با Taq polymerase این یون عمدتاً به صورت ترکیب کلرید منیزیم در واکنش PCR استفاده می شود. این ترکیب گاهی در همان بافر PCR قرار داده می شود ولی از آنجا که برای برخی واکنش های PCR لازم است که غلظت این یون تغییر نماید، این ترکیب به طور جداگانه تهیه و به واکنش PCR افزوده می شود. غلظت بهینه یون منیزیم در واکنش PCR یک تا چهار میلی مولار است. غلظت بالاتر از این مقدار باعث تکثیر قطعاتی غیر از قطعه مورد نظر (قطعات غیر اختصاصی) شده و غلظت پایین این یون نیز ممکن است به کاهش کارایی واکنش و میزان تولید قطعه مورد نظر منجر شود. - پرایمرها غلظت بهینه پرایمرها برای واکنش PCR از ۱۰۰ نانو مولار تا یک میکرو مولار متغییر است. غلظت بیش از این، منجر به تولید قطعات غیر اختصاصی می شود. طراحی پرایمر نیازمند دقت فراوانی است و مرحله بسیار مهمی در امکان پذیر شدن و صحت تکثیر قطعه مورد نظر دارد. دمای مرحله اتصال در برنامه PCR به توالی پرایمرها ارتباط دارد. وسایل مورد نیاز برای واکنش PCR حداقل وسایل مورد نیاز برای انجام واکنش PCR، دستگاه ترموسایکلر (ایجاد کننده چرخه های دمایی)، میکرو پیپت، ظرف یخ و وسایل یکبار مصرفی مانند تیپ (جز پلاستیکی که برای کشیدن محلول به میکرو پیپت متصل می شود) و ویال (لوله های درب دار کوچک، در دو اندازه بر اساس گنجایش آنها یعنی ۲۰۰ و ۵۰۰ میکرو لیتر، که واکنش PCR در آنها انجام می شود) و ظروف نگهداری آنها می باشد. دستگاه ترموسایکلر برای ایجاد دماهای مختلف در مدت زمان مورد نظر، قابل برنامه ریزی می باشد. قبل از تولید این دستگاه، دانشمندان برای انجام PCR از سه حمام آب گرم با دماهای مختلف استفاده می کردند که کار بسیار پر زحمتی بود. میکرو پیپت برای برداشتن مقادیر اندک مورد نیاز برای واکنش PCR در مقیاس میکرو لیتر استفاده می شود. بر روی این دستگاه که کار کردن با آن بسیار راحت است، تیپ های یک بار مصرف قرار داده می شود و بدین وسیله حجم مورد نظر از آن برداشته و به واکنش PCR افزوده می شود. نوشته: کسری اصفهانی سرویس خبری بیوتکنولوژی ایران
PCR یا واکنش زنجیره ای پلیمراز (Polymerase Chain Reaction)، تکنیکی است که با استفاده از آن می توان در مدت زمان کوتاهی قطعه خاصی از مولکول DNA را در شرایط آزمایشگاهی میلیون ها بار تکثیر نمود. این قطعه DNA ممکن است یک ژن، بخشی از یک کروموزوم یا بخش هایی از ژنوم یک موجود باشد. البته در تکثیر DNA با روش PCR محدودیت هایی نیز وجود دارد که مهمترین آنها اندازه قطعات قابل تکثیر می باشد به طوری که حداکثر اندازه قطعه هایی که با روش PCR معمولی تکثیر می گردد، ۵ هزار نوکلئوتید (kb 5) و در روش های بهینه شده تا ۲۰ هزار نوکلئوتید (kb 20) می باشد. با این تعریف، PCR همانند یک دستگاه فتوکپی عمل می کند که بوسیله آن می توان صفحاتی از کتاب ژنوم هر موجود را به تعداد دلخواه و مشابه نسخه اصلی (البته در مواردی همراه با خطاهای جزئی) تکثیر نمود. اساس این روش بسیار ساده بوده و مانند واکنش همانندسازی DNA در موجودات زنده توسط آنزیم DNA پلیمراز صورت می گیرد. در موجودات زنده، مجموعه ای از چند پروتئین و آنزیم در فرآیند همانند سازی DNA نقش دارند در حالی که در واکنش PCR تنها نوع خاصی آنزیم DNA پلیمراز مقاوم به حرارت به نام Taq polymerase به همراه بافر، کلرید منیزیم و نوکلئوتیدها جهت تکثیر قطعات DNA استفاده می شود. مخترع واکنش PCR کَری مولیس (Kary Mullis) می باشد که در سال ۱۹۸۳ این روش را جهت تکثیر DNA معرفی کرد. قبل از این کشف، ساخت قطعات DNA با روش های کند و پر هزینه شیمیایی انجام می گرفت. به دلیل اهمیت این اختراع، کاربردهای فراوان و نقش ارزنده آن در پیشرفت علم ژنتیک و زیست شناسی مولکولی، وی جایزه نوبل شیمی را در سال ۱۹۹۳ دریافت کرد. واکنش PCR به طور روزمره در اکثر آزمایشگاه های تشخیصی و تحقیقاتی استفاده می شود و در موارد بسیاری مثل شناسایی و جداسازی ژن ها، کلونینگ، طبقه بندی و شناسایی موجودات زنده، تشخیص بیماری های ژنتیکی و حتی پرونده های جنایی و تعیین هویت کاربرد دارد. در حال حاضر و نزدیک به ۳۰ سال پس از کشف PCR، تحقیقات ژنتیک مولکولی بدون استفاده از این تکنیک قابل تصور نیست. سازوکار (برنامه) واکنش PCR اساس واکنش PCR جهت تکثیر توالی DNA دو رشته ای، تغییرات دمایی می باشد. در ابتدا پیوندهای هیدروژنی دو رشته توالی DNA با حرارت (۹۴-۹۵ درجه سلسیوس) شکسته و دو رشته از یکدیگر جدا می شوند. سپس دمای واکنش پایین آورده می شود (معمولاً ۵۰ تا ۶۰ درجه سلسیوس). در این مرحله، دو قطعه کوتاه DNA تک رشته ای (معمولاً بین ۱۸ تا ۳۰ نوکلئوتید) که دقیقاً مشابه دو طرف قطعه DNA مورد نظر برای تکثیر طراحی و ساخته شده اند (با نام پرایمر یا آغازگر)، به توالی های مکمل خود در دو رشته باز شده DNA متصل می گردند. این دو قطعه انتهای ۳’ آزاد جهت فعالیت آنزیم DNA پلیمراز را فراهم می نماید، کاری که در همانند سازی در موجودات زنده توسط آنزیم پریماز و توالی اولیه ساخته شده توسط آن انجام می گیرد. در مرحله بعد، دمای واکنش تا ۷۲ درجه سلسیوس (دمای مناسب آنزیم Taq polymerase) افزایش یافته و عمل تکثیر قطعه DNA مورد نظر بین دو پرایمر با استفاده از نوکلئوتیدهای موجود، توسط آنزیم Taq polymerase مقاوم به حرارت انجام می پذیرد. این ۳ مرحله بین ۲۵ تا ۴۰ بار تکرار می شود که به آن چرخه های PCR می گویند. مرحله اول: واسرشت سازی (Denaturation)، ۳۰ تا ۶۰ ثانیه عمل انجام شده در این مرحله: جدا شدن دو رشته DNA مرحله دوم: اتصال (Annealing)، ۳۰ تا ۶۰ ثانیه عمل انجام شده در این مرحله: اتصال پرایمرها به نواحی مکمل روی DNA و تعیین محدوده تکثیر قطعه DNA مرحله سوم: گسترش (Extension یا Elongation)، به ازای هر ۱۰۰۰ نوکلئوتید طول قطعه ۶۰ ثانیه عمل انجام شده در این مرحله: تکثیر قطعه DNA مورد نظر اجزا واکنش PCR در یک واکنش PCR از نمونه DNA، آنزیم Taq polymerase، پرایمرها، بافر، یون منیزیم، نوکلئوتیدها و آب حضور استفاده می شود. توضیحات مربوط به هر یک از این اجزا در ادامه ارائه شده است: - نمونه DNA (الگو) تکثیر از روی نمونه DNA انجام می شود. این نمونه می تواند، قطعه ای DNA، محصول استخراج DNA ژنومی، DNA پلاسمیدی یا حتی محصول PCR دیگری باشد. معمولاً حدود یک نانوگرم از DNA پلاسمیدی یا فاژی یا یک میکروگرم از DNA ژنومی برای یک واکنش PCR کافی است. بیش از این مقدار، باعث تولید محصولات غیر اختصاصی (قطعات DNA دیگری غیر از قطعه مورد نظر) شده و مقدار کم نمونه DNA نیز باعث کاهش دقت واکنش PCR یا عدم تکثیر قطعه مورد نظر می گردد. کیفیت نمونه DNA نیز مهم است به طوری که باقی ماندن ترکیبات مورد استفاده در مرحله استخراج DNA مثل فنل و EDTA، باعث کاهش فعالیت آنزیم Taq polymerase و عدم حصول نتیجه مورد نظر می گردد. همچنین آلوده شدن واکنش PCR با مقادیر بسیار اندک DNA از هر منبع دیگری، به دلیل حساسیت فوق العاده این تکنیک، ممکن است به تولید قطعات غیر قابل انتظار بیانجامد. - آنزیم Taq polymerase این آنزیم برای تکثیر قطعات کمتر از سه هزار جفت باز توصیه شده و پر مصرف ترین آنزیم مورد استفاده در PCR می باشد. به طور معمول حدود یک واحد از این آنزیم در ۵۰ میکرو لیتر از واکنش PCR استفاده می شود. اگر نمونه DNA حاوی مواد ممانعت کننده PCR باشد، می توان این مقدار را دو تا سه برابر افزایش داد ولی مقادیر بالاتر آنزیم باعث تولید محصولات غیر اختصاصی می گردد. گرچه دمای مناسب برای این آنزیم ۷۲ درجه سلسیوس می باشد ولی چون این آنزیم در دمای معمولی نیز قادر به تکثیر می باشد برای جلوگیری از اتصال قطعات پرایمر به نقاط دیگری روی توالی نمونه DNA و امکان تولید قطعات غیر اختصاصی، توصیه می شود که تمامی مراحل آماده سازی واکنش PCR بر روی یخ صورت گیرد. - نوکلئوتید ها چهار نوکلئوتید تشکیل دهنده قطعه DNA از اجزا واکنش PCR می باشند که به عنوان واحد های ساختمانی مورد نیاز در ساخت قطعه DNA استفاده می شوند. غلظت مورد نیاز از هر یک از نوکلئوتیدها برای واکنش PCR یکسان و برابر ۲۰۰ نانو مولار می باشد. برای این منظور از مخلوط های آماده واجد هر چهار نوکلئوتید که با غلظت های مختلف مثل دو میلی مولار، ۱۰ میلی مولار و ۲۵ میلی مولار موجود است، استفاده می شود. به طور مثال، در یک واکنش ۵۰ میکرو لیتری PCR باید ۵ میکرو لیتر از مخلوط دو میلی مولار نوکلئوتیدها برای دستیابی به مقدار مورد نیاز در واکنش استفاده کرد. - بافر مهمترین نقش بافر PCR تنظیم pH مناسب واکنش PCR و آنزیم Taq polymerase می باشد. اجزای این بافر نقش های دیگری نیز دارند از جمله کلرید پتاسیم که به اتصال پرایمر به DNA الگو (نمونه) کمک می کند. - یون منیزیم یون منیزیم یکی از اساسی ترین اجزا واکنش PCR می باشد. انواع مختلف آنزیم DNA polymerase برای فعالیت خود به این یون نیاز دارند و این یون برای اتصال پرایمر و قطعه DNA لازم است. برای تکثیر با Taq polymerase این یون عمدتاً به صورت ترکیب کلرید منیزیم در واکنش PCR استفاده می شود. این ترکیب گاهی در همان بافر PCR قرار داده می شود ولی از آنجا که برای برخی واکنش های PCR لازم است که غلظت این یون تغییر نماید، این ترکیب به طور جداگانه تهیه و به واکنش PCR افزوده می شود. غلظت بهینه یون منیزیم در واکنش PCR یک تا چهار میلی مولار است. غلظت بالاتر از این مقدار باعث تکثیر قطعاتی غیر از قطعه مورد نظر (قطعات غیر اختصاصی) شده و غلظت پایین این یون نیز ممکن است به کاهش کارایی واکنش و میزان تولید قطعه مورد نظر منجر شود. - پرایمرها غلظت بهینه پرایمرها برای واکنش PCR از ۱۰۰ نانو مولار تا یک میکرو مولار متغییر است. غلظت بیش از این، منجر به تولید قطعات غیر اختصاصی می شود. طراحی پرایمر نیازمند دقت فراوانی است و مرحله بسیار مهمی در امکان پذیر شدن و صحت تکثیر قطعه مورد نظر دارد. دمای مرحله اتصال در برنامه PCR به توالی پرایمرها ارتباط دارد. وسایل مورد نیاز برای واکنش PCR حداقل وسایل مورد نیاز برای انجام واکنش PCR، دستگاه ترموسایکلر (ایجاد کننده چرخه های دمایی)، میکرو پیپت، ظرف یخ و وسایل یکبار مصرفی مانند تیپ (جز پلاستیکی که برای کشیدن محلول به میکرو پیپت متصل می شود) و ویال (لوله های درب دار کوچک، در دو اندازه بر اساس گنجایش آنها یعنی ۲۰۰ و ۵۰۰ میکرو لیتر، که واکنش PCR در آنها انجام می شود) و ظروف نگهداری آنها می باشد. دستگاه ترموسایکلر برای ایجاد دماهای مختلف در مدت زمان مورد نظر، قابل برنامه ریزی می باشد. قبل از تولید این دستگاه، دانشمندان برای انجام PCR از سه حمام آب گرم با دماهای مختلف استفاده می کردند که کار بسیار پر زحمتی بود. میکرو پیپت برای برداشتن مقادیر اندک مورد نیاز برای واکنش PCR در مقیاس میکرو لیتر استفاده می شود. بر روی این دستگاه که کار کردن با آن بسیار راحت است، تیپ های یک بار مصرف قرار داده می شود و بدین وسیله حجم مورد نظر از آن برداشته و به واکنش PCR افزوده می شود. نوشته: کسری اصفهانی سرویس خبری بیوتکنولوژی ایران