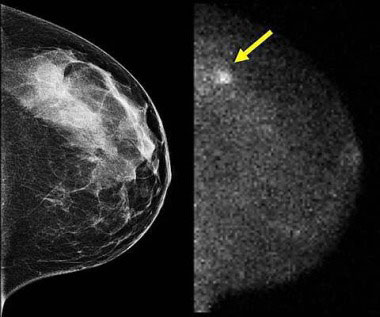
قلب چیست و چگونه کار می کند؟
قلب اساساً یک پمپ عضلانی توخالی است که بدون توقف خون را به سراسر بدن پمپ می کند. اگرچه قلب بزرگتر از مشت دست نیست ؛ ولی در طول دوران عمر در حدود 300 میلیون لیتر خون را پمپ می کند. رگ های بزرگ خون که به قلب متصل اند خون را به ریه ها و سراسر بدن می برند و باز می گردانند.
قلب در موجودات مختلف است.
برای مثال قلب ماهی دو حفره ای است ولی قلب انسان چهار حفره دارد که در ادامه به آن بحث خواهیم کرد.
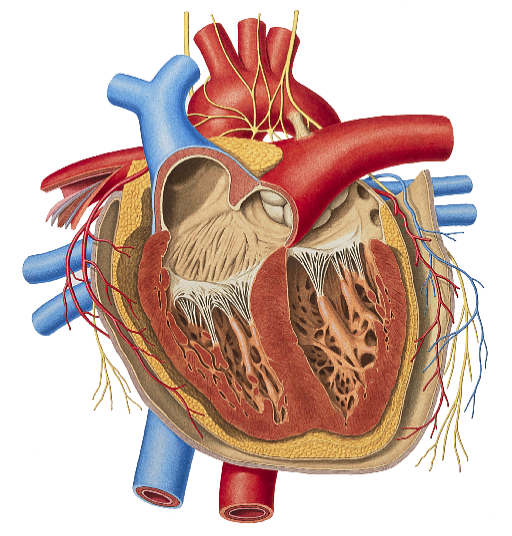
قلب انسان
قلب انسان همان طوری که قبلا اشاره شد چهار حفره دارد و دارای 2 دهلیز و 2 بطن است. خون در قلب انسان به دو مسیر پمپاژ می شود ؛ مسیر اول که مسیر گردش خون کوتاه است ، در سمت راست قلب خون از سیاهرگ های زیرین و زبرین وارد دهلیز راست می شود و سپس از طریق دریچه سه لختی که دربین دهلیز و بطن راست قرار دارد وارد بطن شده و بر اثر انقباض بطن از طریق سرخرگ ششی (تنه ریوی) به شش ها برده می شود و خون در شش ها به تبادل اکسیژن و دی اکسید کربن با هوای داخل شش ها می پردازد و سپس خون تصفیه شده دوباره توسط سیاهرگی وارد قلب می شود ولی این بار به قسمت چپ قلب وارد می شود. یعنی ابتدا وارد دهلیز چپ و سپس توسط دریچه میترال وارد بطن چپ می شود و با انقباض بطن خون وارد آئورت (بزرگترین سرخرگ بدن) می شود و در تمام قسمت های بدن خون در رگ ها و مویرگ ها حرکت می کند و در مویرگ ها در میان سلول های بدن جریان می یابد و مواد و اکسیژن و دی اکسید کربن و سایر مواد را با سلول ها مبادله می کند (به وسیله فشار تراوشی و اسمزی).
قلب از سه نوع ماهیچه به نام های ماهیچه آندوکارد ، میوکارد و پریکارد تشکیل شده است که میوکارد ماهیچه قابل انقباض قلب را تشکیل می دهد. آندوکارد لایه پوششی حفره های دهلیز و بطن است و پریکارد پوشش آبشامه قلب را می سازد. علاوه بر ماهیچه های فوق ، نوع دیگری از بافت به نام بافت گرهی در قلب وجود دارد.
بافت گرهی محل اصلی زایش تحرکات و انقباض های قلب است.
دو نوع بافت گرهی در قلب وجود دارد: بافت گرهی پیشاهنگ و بافت گرهی دهلیزی بطنی. گره پیشاهنگ در دهلیز راست و زیر بزرگ سیاهرگ زبرین قرار دارد و محل اصلی زایش انقباض های قلب می باشد و با تولید پیام هایی ، این پیام ها به سمت گره دهلیزی بطنی که در بین بطن و دهلیز قرار دارد می روند و به این ترتیب در تمام قسمت های قلب پخش شده و باعث انقباض آن می شود و به این ترتیب می شود که قلب انقباض یافته و خون را به داخل سرخرگ ها انتقال می دهد.
انقباض دهلیز و انقباض بطن و استراحت قلب به ترتیب 0/1 ، 0/3 و 0/4 ثانیه طول می کشد. جالب است بدانید قلب ما با هر انقباض 140 میلی لیتر خون را وارد سرخرگ ها می کند.
نکته قابل توجه این است که با وجود اینکه سلول های قلب دائماً با خون موجود در قلب ارتباط دارند اما با این حال از آن برای تأمین نیازهای خود استفاده نمی کنند و به جای آن از خون رگ های خاصی که در بین سلول های قلب منشعب می شوند استفاده می کنند.
آناتومی قلب
این عضو مخروطی شکل بصورت کیسهای عضلانی تقریباً در وسط فضای قفسه سینه (کمی متمایل به جلو و طرف چپ) ابتدا در دل اسفنج متراکم و وسیعی مملو از هوا یعنی ریهها پنهان شده و سپس توسط یک قفس استخوانی بسیار سخت اما قابل انعطاف مورد محافظت قرار گرفته است. ابعاد قلب در یک فرد بزرگسال حدود 6x9x12 سانتیمتر و وزن آن در آقایان حدود 300 و در خانم ها حدود 250 گرم (یعنی حدود 0.4 درصد وزن کل بدن) میباشد.
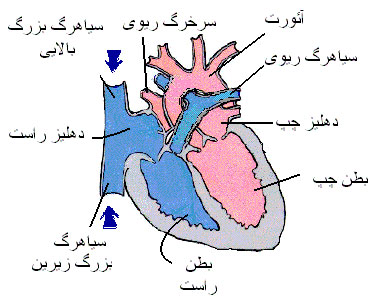
قلب توسط یک دیواره عضلانی عمودی به دو نیمه راست و چپ تقسیم میشود. نیمه راست مربوط به خون سیاهرگی و نیمه چپ مربوط به خون سرخرگی است. هر یک از دو نیمه راست و چپ نیز مجدداً بوسیله یک تیغه عضلانی افقی نازکتر به دو حفره فرعی تقسیم میشوند. حفره های بالایی که کوچکتر و نازکتر هستند ، به نام دهلیز موسوم بوده و دریافت کننده خون میباشند. حفرههای پایینی که بزرگتر و ضخیمترند ، بطن های قلبی هستند و خون دریافتی را به سایر اعضاء بدن پمپ میکنند. پس قلب متشکل از چهار حفره است: دو حفره کوچک در بالا (دهلیزهای راست و چپ) و دو حفره بزرگ در پایین (بطن های راست و چپ).
شریان های کرونری
شریان های کرونری از آئورت بیرون میآیند. آئورت ، شریان یا سرخرگ اصلی بدن میباشد که از بطن چپ ، خون را خارج میسازند. شریان های کرونری از ابتدای آئورت منشأ گرفته و بنابراین اولین شریان هایی هستند که خون حاوی اکسیژن زیاد را دریافت میدارند. دو شریان کرونری (چپ و راست ) نسبتاً کوچک بوده و هر کدام فقط 3 یا 4 میلیمتر قطر دارند.
این شریان های کرونری از روی سطح قلب عبور کرده و در پشت قلب به یکدیگر متصل میشوند و تقریباً یک مسیر دایرهای را ایجاد میکنند. وقتی چنین الگویی از رگ های خونی قلب توسط پزشکان قدیم دیده شد ، آنها فکر کردند که این شبیه تاج میباشد ؛ به همین دلیل کلمه لاتین شریان های کرونری (Coronary یعنی تاج) را به آنها دادند که امروزه نیز از این کلمه استفاده میشود. از آنجایی که شریان های کرونری قلب از اهمیت زیادی برخوردار هستند ، پزشکان تمام شاخهها و تغییراتی که میتواند در افراد مختلف داشته باشد را شناسایی کردهاند. شریان های کرونری چپ دارای دو شاخه اصلی میباشد که به آنها اصطلاحاً نزولی قدامی و شریان سیرکومفلکس یا چرخشی میگویند و این شریان ها نیز به نوبه خود به شاخههای دیگری تقسیم میشوند.
این شریان ها ، باعث خونرسانی به قسمت بیشتر عضله بطن چپ میشوند. بطن چپ دارای عضلات بیشتری نسبت به بطن راست میباشد ، زیرا وظیفه آن تلمبه کردن خون به تمام قسمت های بدن است. شریان های کرونری راست ، معمولا کوچکتر بوده و قسمت زیرین قلب و بطن راست را خونرسانی میکند . وظیفه بطن راست تلمبه کردن خون به ریهها میباشد. شریان های کرونری دارای ساختمانی مشابه تمام شریان های بدن هستند اما فقط در یک چیز با آنها تفاوت دارند که فقط در زمان بین ضربان های قلب که قلب در حالت ریلکس و استراحت قرار دارد ، خون در این شریان ها جریان مییابد.
وقتی عضله قلب منقبض میشود ، فشار آن به قدری زیاد میشود که اجازه عبور خون به عضله قلب را نمیدهد ، به همین دلیل قلب دارای شبکه موثری از رگ های باریک خونی است که تمام نیازهای غذایی و اکسیژن رسانی آن را به خوبی برآورده میکند. در بیماران کرونری قلب ، شریان های کرونری تنگ و باریک میشوند و عضلات قلب از رسیدن خون و اکسیژن به اندازه کافی محروم میگردند. (مانند هنگامی که که یک لوله آب به دلایل مختلفی تنگ شود و نتواند به خوبی آبرسانی کند.)
در این صورت ، در حالت استراحت ممکن است اشکالی برای فرد ایجاد نشود اما وقتی که قلب مجبور باشد کار بیشتری انجام دهد و مثلا شخص بخواهد چند پله را بالا برود ، شریان های کرونری نمیتوانند بر اساس نیاز اکسیژن این عضلات ، به آنها خون و اکسیژن برسانند و در نتیجه شخص در هنگام بالا رفتن از پلهها دچار درد سینه و آنژین قلبی میگردد. در چنین مواقعی اگر فرد کمی استراحت کند ، درد معمولا از بین خواهد رفت. اگر یک شریان کرونری به علت مسدود شدن آن توسط یک لخته خون ، به طور کامل جلوی خونرسانیاش گرفته شود ، قسمتی از عضله قلب که دیگر خون به آن نمیرسد خواهد مرد و این به معنای سکته قلبی است.
ضربان قلب
همانگونه که میدانید قلب نوعی تلمبه است. خون به وسیله آن در بدن جریان مییابد و زندگی را برای جاندار مسیر میسازد ؛ اما چه تلمبه حیرتزایی! قلب در هر تپش تقریباً صد سانتیمتر مکعب خون را در بدن پخش میکند. روزانه حدود 10 هزار لیتر خون به وسیله این تلمبه در درون رگهای هدایت میشود. در مدت عمر متوسط یک انسان شاید 250 میلیون لیتر خون به وسیله قلب تلمبه زده شود. طول مدت هر تپش قلب انسان ، کمی بیش از هشتدهم ثانیه است. بنابراین ، قلب روزی صدهزار بار میتپد و در فاصله هر یک تپش به مدتی برابر زمان یک تپش ، به استراحت میپردازد. پس قلب روزانه حدود 6 ساعت آرامش دارد. این که میگوییم «تپش» قلب ، مقصودمان بسته و باز شدن آن است ؛ یعنی انقباض و انبساط آن. تلمبه قلب در حالت انقباض (بسته شدن) خون را بیرون میراند ؛ اما در حالت انبساط (باز شدن) خون را به درون قلب میکشد. البته گمان نکنید که این کار به سادگی مثلا باز و بسته شدن مچ دست صورت میگیرد ، خیر ؛ بلکه انقباض قلب بهصورت نوعی موج از پایین قلب شروع شده تا به بالای آن حرکت میکند. اکنون باید دید عامل این تپش چیست؟ به عبارت دیگر ، چه چیز سبب ادامه تپیدن قلب است؟ آیا انقباض و انبساط آن یک عامل خارجی دارد یا از درون خود قلب برمیآید؟ این مسأله یکی از جالبترین پرسشها در زیستشناسی است که در پاسخ آن هنوز بسی ابهام وجود دارد.
با این وصف ، اکنون برایتان آزمایشی را تعریف میکنم که از صدها سال پیش ، دانشمندان با آن آشنا بودهاند. فرض کنید تخم مرغی را حدود 24 ساعت در ماشین جوجهکشی حرارت دهیم ، حال اگر آن را بشکنیم و با ذرهبین به درون آن بنگریم ، خواهیم دید که سلولهایی که قرار است بعداً قلب جوجه را تشکیل دهند ، از هماکنون میتپند. آری ، این یاختهها از هماکنون که هنوز قلبی درست نشده است ، تپش را آغاز کردهاند! باز فرض کنید این سلولها را برداریم و در یک مدیوم (یعنی «ماده کشت مخصوص») پرورش دهیم. خواهیم دید که قلب رشد میکند و سپس اگر آن را به شش قسمت برش دهیم ، باز خواهیم دید که هر قسمت آن تا مدتی عمل «انقباض» را انجام میدهد. دلیلش چیست؟ ما نمیدانیم ؛ فقط این را میتوانیم بگوییم که قلب دارای این ویژگی است که بهطور خودکار میتواند عمل باز و بسته شدن را انجام دهد. نتیجه این که تپیدن دایمی قلب هنوز از معماهای زندگی است!
بیماری های قلبی
گرفتگی رگ های قلب
آترواسكلروز سرخرگ های قلب عبارت است از تصلب و باریک شدن فضای داخل سرخرگ های قلب. قلب سه سرخرگ اصلی دارد. زمانی كه هر كدام یا همگی تنگ شوند ، آنها دیگر نمی توانند اكسیژن كافی به سلول های قلب برسانند. این بیماری مردان و زنان بالای ۴۰ سال را متأثر می سازد اما پیش از یائسگی در زنان كمتر شایع است.
علایم شایع
مراحل اولیه:
ـ اغلب بدون علامت است.
مراحل بعدی:
ـ آنژین صدری (احساس سوزش ، فشردگی ، سنگینی یا گرفتگی در قفسه سینه كه ممكن است به بازوی چپ ، گردن ، فک یا كتف گسترش پیدا كند.)
علل بیماری
- سیگار كشیدن
- بالا بودن فشارخون
- سابقه خانوادگی بیماری سرخرگ های قلب ، دیابت ، فشار خون بالا یا آترواسكلروز
- تغذیه نامناسب ، خصوصاً وجود چربی زیاد در رژیم غذایی
- سابقه حمله قلبی یا سكته مغزی
- ورزش نكردن
- شخصیت تهاجمی یا ناشكیبا
- اضافه وزن
- استفاده مداوم از روغن های نباتی مایع و جامد که چربی های مضر در بدن تولید کرده و باعث گرفتگی رگ ها می شوند.
- مصرف نکردن روغن های طبیعی مانند روغن گاوی ، روغن زیتون و مواد طبیعی
- استفاده از شیرینی جات ، خوراکی ها و مواد غیر طبیعی مانند پیتزا ، شیرینی ، شکلات و ...
- افزایش كلسترول یا LDL (لیپوپروتیئن با چگالی كم ـ كلسترول بد) و یا كاهش HDL (لیپوپروتئین با چگالی زیاد ـ كلسترول خوب) در خون
عوارض احتمالی
انفاركتوس قلب (مرگ سلول های عضله قلب در اثر نرسیدن خون به حد كافی) كه زندگی را در معرض تهدید قرار می دهد.
فعالیت
یک برنامه ورزشی روزانه و در حد متوسط داشته باشید. از فعالیت های جنسی مستمر و پشت سرهم پرهیز کنید.
رژیم غذایی
ـ رژیم غذایی دارای چربی كم (اما با روغن های طبیعی)
سكته قلبی (MI)
یک حمله قلبی (سکته قلبی) زمانی رخ می دهد که یک منطقه از عضله قلب به علت نرسیدن اکسیژن کافی به آن محل دچار صدمه دائمی یا مرگ شود.
علل ،شیوع و عوامل خطر
بیشتر حملات قلبی توسط یک لخته که یکی از رگ های کرونر را مسدود می کند (رگ های خونی که خون و اکسیژن را به عضله قلب می رسانند) ایجاد می شوند. لخته معمولاً در یک رگ کرونر که قبلاً به علت تغییرات آترواسکلروز باریک شده ، تشکیل می شود. پلاک آترواسکلروزی داخل دیواره رگ گاهی ترک بر می دارد و این امر تشکیل لخته را که ترومبوز نیز نامیده می شود ، شروع می کند.
لخته درون رگ کرونری جریان خون و اکسیژن رسانی به عضله قلبی را مختل می کند که سبب مرگ سلول های قلبی در آن ناحیه می شود. ماهیچه قلبی آسیب دیده توانایی خود برای انقباض را از دست می دهد و عضله قلبی باقیمانده برای جبران منطقه آسیب دیده وارد عمل خواهد شد.
گاهی استرس شدید ناگهانی می تواند یک حمله قلبی را شروع کند.
تخمین دقیق شیوع حملات قلبی دشوار است ، زیرا حدود 200,000 تا 300,000 بیمار هر ساله در آمریکا قبل از رسیدن به خدمات پزشکی می میرند. تخمین زده می شود که تقریباً 1 میلیون بیمار هر ساله با حمله قلبی به بیمارستان مراجعه می کنند.
عوامل خطر برای بیماری عروق کرونر و حمله قلبی عبارتند از:
• سیگار
• فشار خون بالا
• چربی زیاد رژیم غذایی
• کنترل نامناسب کلسترول خون ، بویژه LDL (کلسترول بد) بالا و HDL (کلسترول خوب) پایین
• بیماری قند خون
• جنس مذکر
• سن
• وراثت
بسیاری فاکتورهای خطر نامبرده به اضافه وزن مربوط است.
عوامل خطر جدید تری برای بیماری عروق کرونر در چند سال گذشته مشخص شده اند. این عوامل شامل هموسیستئین بالا ، (CRP (C-reactive protein و سطح فیبرینوژن است. هموسیستئین یک اسید آمینه است. CRP با واکنش های التهابی مرتبط است و فیبرینوژن یک جزء سیستم انعقادی خون است. هموسیستئین بالا با مشتقات اسید فولیک قابل درمان است. تحقیقات همچنان در مورد ارزش عملی این فاکتورهای جدید ادامه دارد.
حملات قلبی مسئول 1 از هر 5 مرگ می باشد. این بیماری یک علت عمده مرگ ناگهانی در بالغین است.
علائم
درد سینه پشت جناغ (استخوان وسط سینه) یک علامت عمده حمله قلبی است ولی در بسیاری افراد بخصوص در افراد مسن و بیماران دیابتی ، درد ممکن است ناچیز یا حتی اصلاً وجود نداشته باشد (بنام "حمله قلبی خاموش"). اغلب درد از ناحیه سینه شما به بازوها یا شانه ، گردن ، دندان ها ، فک ، شکم یا پشت انتشار می یابد. گاهی اوقات درد تنها در یکی از این نواحی احساس می شود.
درد بطور معمول بیش از 20 دقیقه طول می کشد و کاملاً با استراحت یا نیتروگلیسرین برطرف نمی شود ، در حالیکه درد آنژین با هردو برطرف می شود.
درد ممکن است شدید و زیاد یا خفیف و نامشخص باشد. درد به صورت های زیر احساس می شود:
• حالت فشاری یا چیز سنگین
• نوار محکم دور سینه
• "یک فیل روی سینه شما نشسته است."
• حالت سوء هاضمه
سایر علائم که ممکن است به تنهایی یا همراه درد سینه باشند ، عبارتند از:
• نفس تنگی
• سرفه
• احساس سبکی سر ، سرگیجه
• غش کردن
• تهوع یا استفراغ
• تعریق (ممکن است شدید باشد.)
• احساس "نزدیک شدن به مرگ"
• اضطراب
نشانه ها و آزمایشات
در حین یک آزمایش بالینی ، پزشک معمولاً متوجه پالس سریع می شود. فشار خون ممکن است طبیعی ، بالا یا پایین باشد. در زمان سمع قفسه سینه با گوشی پزشکی ، پزشک ممکن است کراکل های ریوی ، سوفل قلبی یا سایر صداهای غیر طبیعی را بشنود.
تست های زیر می توانند حمله قلبی و میزان صدمه قلبی را نشان دهند:
• تست نوار قلب (ECG) - یک عدد یا مکرر در عرض چند ساعت
• اکو کاردیوگرافی
• آنژیوگرافی قلب
• ونتریکولوگرافی هسته ای
تست های زیر فرآورده های ناشی از آسیب قلب و فاکتورهای مبین خطر بالای حمله قلبی را نشان می دهند:
• تروپونین آی و تروپونین تی (پروتئین های درگیر در انقباض عضلانی)
• CPK و CPK-MB
• میوگلوبین سرم
درمان
حمله قلبی یک اورژانس پزشکی است! بستری و احتمالاً مراقبت های ویژه مورد نیاز است. پایش مداوم نوار قلب سریعاً آغاز می شود ، زیرا آریتمی های کشنده (ضربانات نامنظم قلبی) مهمترین علت مرگ در چند ساعت اول پس از حمله قلبی هستند.
اهداف درمان شامل توقف پیشرفت حمله قلبی ، کاهش بار قلب و پیشگیری از عوارض می باشد.
داروها و مایعات مستقیماً از راه یک کاتتر داخل وریدی به درون یک سیاهرگ تزریق می شوند. وسایل پایش متعددی ممکن است لازم باشد. یک سوند ادراری برای پایش دقیق وضع مایعات گذاشته می شود.
معمولاً اکسیژن تجویز می شود ، حتی اگر اکسیژن خون طبیعی باشد. این امر اکسیژن کافی در اختیار بافت های بدن می گذارد و کار قلب را کم می کند.
داروهای ضد درد:
نیترو گلیسرین وریدی یا سایر داروها برای کنترل درد و کاهش نیاز قلب به اکسیژن بکار می روند. مورفین و داروهای مشابه ضد دردهای قوی هستند که ممکن است برای یک حمله قلبی تجویز شوند.
داروهای ضد انعقادی:
اگر EKG ثبت شده حین درد قلبی بصورت بالا رفتن قطعه ST باشد ، داروهای ترومبولیتیک (داروهای حل کننده لخته) در عرض 12 ساعت پس از شروع درد سینه ممکن است شروع شوند. این درمان ترومبولیتیک در ابتدا به صورت تزریق آرام استرپتوکیناز یا فعال کنندۀ پلاسمینوژن بافتی شروع و با تزریق وریدی هپارین دنبال می شود.
درمان با هپارین به منظور پیشگیری از تشکیل لخته های جدید ، برای 48 تا 72 ساعت ادامه می یابد. علاوه بر این وارفارین (کومادین) که خوراکی مصرف می شود ، ممکن است جهت پیشگیری از تشکیل لخته های بیشتر تجویز شود.
درمان ترومبولیتیک برای بیمارانی که دارای خصوصیات زیر باشند مناسب نیست:
• خونریزی های داخل سر مثل خونریزی داخل جمجمه ای
• اشکالات مغزی مثل تومورها یا ناهنجاری های رگ های خونی
• سکته مغزی در 3 ماه گذشته (یا احتمالاً بیشتر)
• ضربه مغزی در 3 ماه گذشته
علاوه بر این ، درمان ترومبولیتیک در افرادی که شرایط زیر را داشته باشند بسیار خطرناک است:
• پرفشاری خون شدید
• جراحی عمده یا تصادف شدید در 3 هفته گذشته
• خونریزی داخلی در 2-4 هفته اخیر
• بیماری زخم پپتیک
این درمان در خانم های حامله و افرادی که داروهای ضد انعقادی مثل کومادین مصرف می کنند بسیار خطرناک است.
مصرف داروهای ترومبولیتیک ممکن است با خونریزی شدید همراه شود. پزشکتان می تواند در انتخاب درمان مناسب به شما کمک کند.
اساس معالجه یک حمله قلبی درمان ضد پلاکتی است. این درمان می تواند از تجمع پلاکت ها در محل آسیب وارده به دیواره رگ خونی (مثل پارگی در پلاک آترواسکلروزی) جلوگیری کند. تجمع پلاکتی و انباشته شدن آنها اولین پدیده ای است که منجر به تشکیل لخته می شود. یک داروی ضد پلاکتی پر مصرف آسپرین است. دو داروی ضد پلاکتی مهم دیگر تیکلوپیدین (تیکلید) و کلوپیدوگرل (پلاویکس) هستند.
سایر داروها:
• مسدود کننده های بتا (مثل متوپرولول ، آتنولول و پروپرانولول) به منظور کاهش بار قلب و پایین آوردن فشار خون استفاده می شوند.
• مهارکننده های آنزیم مبدل آنژیوتنسین (مانند رامیپریل ، لیزینوپریل ، انالاپریل یا کاپتوپریل) برای پیشگیری از نارسایی قلب و کاهش فشار خون مصرف می شوند.
جراحی و سایر اقدامات
آنژیوپلاستی اورژانس کرونر ممکن است برای باز کردن شریانهای کرونر مسدود لازم باشد. این روش درمانی را می توان بجای درمان ترومبولیتیک استفاده کرد یا در بیمارانی که داروهای ترومبولیتیک نباید استفاده شوند ممکن است بکار رود. وسیله ای بنام استنت اغلب حین آنژیوپلاستی داخل شریان گذاشته می شود. این امر برای اطمینان بیشتر است که شریان کرونری تازه باز شده بعد از جراحی همچنان باز بماند. پيوند بایپس عروق كرونری بصورت اورژانس ممکن است در برخی بیماران نیاز باشد.
شواهد اخیر حاکی از آن است که استفاده از آنژیوپلاستی و استنت گذاری می تواند اولین قدم درمانی برای باز کردن شریان قلبی مسدود باشد ؛ به شرطی که این روش در زمان مشخص در مرکز مجهز صورت گیرد. اگر این روش در دسترس نباشد ، استفاده از درمان ترومبولیتیک پیشنهاد می شود.
پیش آگهی
پی آمد بیماری بسته به وسعت و حجم بافت آسیب دیده متفاوت است. پی آمد بیماری در صورت آسیب به سیستم هدایت الکتریکی قلب (سیستم الکتریکی که انقباض قلب را کنترل می کنند) وخیم خواهد بود.
تقریباً یک سوم موارد منجر به مرگ می شود. اگر بیمار 2 ساعت پس از حمله زنده بماند ، احتمال زنده ماندن زیاد است ولی ممکن است با عوارض همراه باشد.
بیماران بدون عارضه ممکن است کامل خوب شوند ؛ حملات قلبی لزوماً فرد را زمین گیر نمی کند. معمولاً فرد به تدریج فعالیت های طبیعی و روزمره ، از جمله فعالیت جنسی را بدست می آورد.
عوارض
آریتمی ها مثل تاکی کاردی بطنی ، فیبریلاسیون بطنی ، بلاک قلبی
• نارسایی احتقانی قلب
• شوک کاردیوژنیک
• گسترش انفارکتوس: گسترش مقدار بافت قلبی آسیب دیده
• پریکاردیت (التهاب پرده اطراف قلب)
• آمبولی ریوی (لخته خون در ریه ها)
• عوارض درمان (برای مثال داروهای ترومبولیتیک شانس خونریزی را زیاد می کنند.)
پیشگیری از حمله قلبی
• فشار خونتان را کنترل کنید.
• سطح کلسترول تام را کنترل کنید. جهت کنترل سطح کلسترول ، پزشکتان ممکن است دارویی از خانواده استاتین ها تجویز کند (آتورواستاتین ، سیمواستاتین).
• اگر سیگاری هستید ، سیگار را ترک کنید.
• غذای کم چربی حاوی میوه و سبزیجات فراوان و فاقد روغن حیوانی مصرف کنید.
• بیماری قند را کنترل کنید.
• اگر چاق هستید ، وزنتان را کم کنید.
• روزانه یا چند بار در هفته پیاده روی یا سایر ورزش هایی که کارآیی قلب را بهبود می بخشد ، انجام دهید. (ابتدا با پزشک خود مشورت کنید.)
اگر دارای یک یا چند فاکتورخطر بیماری های قلبی هستید ، با پزشکتان در مورد تجویز آسپرین برای پیشگیری از حمله قلبی تماس بگیرید.
بعد از یک حمله قلبی ، پیگیری بیمار برای کاهش خطر بروز یک حمله دیگر ضروری است. اغلب یک برنامه بازتوانی قلبی برای بازگشت به زندگی روزمره توصیه می شود. برنامه ورزش ، تغذیه و داروها را مطابق تجویز پزشکتان ادامه دهید.
دیابت یکی از عوامل سکته قلبی
دیابت یک عامل خطر مهم و بزرگ برای بیماری های قلبی و سکته است. حدود 65 درصد افرادی که دیابت دارند به علت انواع مختلفی از بیماریهای قلبی عروقی می میرند. به ویژه زنان دیابتی خطر بالایی برای مردن از بیماریهای قلبی-عروقی و سکته ی قلبی دارند.
کسانی که دیابت دارند ، باید فشار خون و کلسترول خود را پایینتر از سطح توصیه شده نگه دارند. نکشیدن سیگار ، داشتن تحرک بدنی و مصرف روزانه ی آسپرین (در صورت توصیه ی پزشک) برای پیشگیری از بیماریهای قلبی مهم هستند.
احتمال سکته ی قلبی یا مغزی در افراد دیابتی 50 درصد بیشتر از کسانی است که قند خون طبیعی دارند. بنابراین بایستی توجه زیادی به کنترل یا پیشگیری فشار خون ، کلسترول خون و دیگر عوامل خطر بیماری های قلبی داشته باشند.
ضعف قلب (نارسایی قلب ، Heart Failure)
این بیماری جداً بد و آزار دهنده و ناتوان کننده می باشد. اعتدال روح بسته به یک جزء حرارت و یک جزء برودت و یک جزء یبوست و یک جزء رطوبت است ، بنابراین اگر در یکی از این اجزاء کمی یا افزونی پیدا شود ، از کار خودش باز می ماند و قلب را ناتوان می کند. به هر حال این بیماری ناشی از غلبه یکی از اخلاط چهار گانه (صفرا ، سودا ، بلغم ، خون) است که در هر نوع باید مزاج را به تعادل رساند. گاهی سبب بیرونی دارد. ناراحتی های فکری و روانی و گاهی از ضعف خود قلب است.
علائم بیماری
سکته های قلبی (خفیف یا قوی) و ناراحتی های قلبی که مربوط به نارسایی قلب می شوند.
خفقان قلب (Asphyxiation ، Suffocation)
این بیماری به علت امتلاء رگ های قلب از خون پیدا می شود و نیز ممکن است از زیادی رطوبت پرده ای که قلب را در بر می گیرد باشد و گاهی از چیرگی حرارت صفرایی و گاهی نیز از بخارهایی است که بسوی قلب می روند. در بعضی اوقات ممکن است سبب چیرگی خون در مزاج باشد و علامتش همان علامات عمومی غلبه خون است و سرخی چهره بیمار ، شدت یافتن تپش سرخرگ ها و نفس نفس زدن بیمار است.
علائم بیماری
نگرانی و استرس بی مورد ، تب